Tocilizumab (TYENNE®) - Biosimilaire
Autre nom : tocilizumab-aazg
Structure : AcM humanisé, IgG1k
Code ATC : L04AC07 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AC Inhibiteurs d'interleukine L04AC07 Tocilizumab)
Nomenclature Ge : IgG1κ G1e0
Cible: IL-6R ; récepteurs solubles et membranaires de l'IL-6
Mode de production : Cellules d'ovaire de hamster chinois (CHO) par technique de l'ADN recombinant
Forme galénique : Seringue ou stylo pré-remplis de 162 mg de tocilizumab ou flacons de 20 mg/mL de solution à diluer pour perfusion (4, 10 ou 20 mL)
Mode d'administration : SC (pour stylos et seringue) ou IV
Conservation : Ce médicament doit être conservé au réfrigérateur (entre + 2 °C et + 8 °C) et sorti du réfrigérateur 45 minutes avant l'injection afin que la solution soit à température ambiante au moment de l'injection sous cutanée. Il ne doit pas être congelé. La seringue et le stylo peuvent être conservé à une température ambiante, inférieure à 25°C pendant 14 jours maximum.
Se conserve 3 ans au réfrigérateur (max 2 ans pour RoActemra)
Date d'AMM : septembre 2023 (EMA)
Laboratoire : Fresenius Kabi
Indications :
- Polyarthrite rhumatoïde : En association avec le méthotrexate (MTX), est indiqué pour le traitement de la polyarthrite rhumatoïde (PR) sévère, active et progressive chez les adultes non traités précédemment par MTX ou dans le traitement de la polyarthrite active modérée à sévère chez les patients adultes qui ont répondu de manière inadéquate ou sont intolérants à un traitement antérieur par un ou plusieurs antirhumatismaux modificateurs de la maladie (DMARDs) ou par des antagonistes du facteur de nécrose tumorale (anti-TNF : Adalimumab, Etanercept, Golimumab, infliximab, Certoluzimab).
- Arthrite juvénile idiopathique (AJI) :
Tyenne est indiqué dans le traitement de l'arthrite juvénile idiopathique (AJI) systémique active chez les patients âgés de 2 ans et plus par seringue ou 12 ans et plus par stylo, qui n'ont pas répondu de manière satisfaisante à un traitement antérieur par AINS et par corticostéroïdes systémiques. Tyenne peut être administré en monothérapie (en cas d'intolérance au MTX ou lorsque le traitement par MTX est inapproprié) ou en association avec le MTX.
En association avec le MTX dans le traitement de l'arthrite juvénile idiopathique polyarticulaire chez les patients âgés de 2 ans et plus pour la seringue et 12 ans et plus pour le stylo qui ont présenté une réponse inadéquate à un précédent traitement par MTX. Il peut être utilisé en monothérapie en cas d'intolérance au MTX ou lorsque la poursuite de ce dernier traitement est inadaptée.
- Artérite à cellules géantes (également appelée maladie de Horton), en association avec une corticothérapie dégressive, chez les patients qui requièrent une épargne cortisonique en cas de corticodépendance à une dose supérieure ou égale à 7,5 mg/jour de prednisone entraînant des rechutes itératives, ou si une décroissance précoce et rapide de la corticothérapie est rendue nécessaire par une intolérance aux corticoïdes ou des comorbidités sévères.
- Syndrome de relargage cytokinique : Tyenne est indiqué dans le traitement du syndrome de relargage cytokinique grave ou potentiellement mortel induit par les CAR-T cells (Lymphocytes T transformés génétiquement dans le but de soigner certains cancers) chez les adultes et les patients pédiatriques âgés de 2 ans et plus (par voie IV)
- Infections sévères par le virus sur Sars-Cov-2 : Tyenne est indiqué pour le traitement de la maladie à coronavirus 2019 (COVID-19) chez les adultes qui reçoivent des corticostéroïdes systémiques et ont besoin d'un supplément d'oxygène ou d'une ventilation mécanique (par voie IV)
Prix indicatif (Mars 2024) : 507,27 € pour 4 stylos/seringues de 162 mg de tocilizumab.
Usage : Médicament de prescription initiale hospitalière annuelle, médicament d'exception. Le renouvellement de la prescription est réservé à certains spécialistes : Médecine interne, pédiatrie, rhumatologie. La forme en seringue/stylo pré-rempli est disponible à l'officine (pour la PAR, l'arthrite juvénile idiopathique et l'artérite à cellules géantes).
Posologies :
- Pour la polyarthrite rhumatoïde, la posologie recommandée est de 8 mg/kg administrée une fois toutes les 4 semaines.
- La posologie recommandée pour l'arthrite juvénile idiopathique (AJI) est de 8 mg/kg toutes les 2 semaines chez les patients dont le poids est supérieur ou égal à 30 kg ou de 12 mg/kg toutes les 2 semaines chez les patients pesant moins de 30 kg.
Pour les personnes dont le poids corporel est supérieur à 100 kg, des doses supérieures à 800 mg par perfusion ne sont pas recommandées.
- La posologie recommandée pour le traitement de COVID-19 est une perfusion intraveineuse unique de 60 minutes de 8 mg/kg chez les patients qui reçoivent des corticostéroïdes systémiques et qui ont besoin d'oxygène supplémentaire ou de ventilation mécanique. Si les signes ou symptômes cliniques s'aggravent ou ne s'améliorent pas après la première dose, une perfusion supplémentaire est nécessaire. L'intervalle entre les deux perfusions doit être d'au moins 8 heures.
- La posologie recommandée pour le traitement du SRC, administrée en perfusion intraveineuse de 60 minutes, est de 8 mg/kg chez les patients dont le poids est supérieur ou égal à 30 kg ou 12 mg/kg chez les patients dont le poids est inférieur à 30 kg. Tyenne peut être administré seul ou en association avec des corticostéroïdes. Si aucune amélioration clinique des signes et symptômes du SRC ne survient après la première dose, jusqu'à 3 doses supplémentaires de Tyenne peuvent être administrées. L'intervalle entre les doses consécutives doit être d'au moins 8 heures. Des doses supérieures à 800 mg par perfusion ne sont pas recommandées chez les patients atteints de SRC.
- Pour le stylo ou la seringue, la posologie est de 162 mg 1X/semaine pour les plus de 30 kg (toutes les 2 à 3 semaines pour AJIs et AJIp si moins de 30 kg)
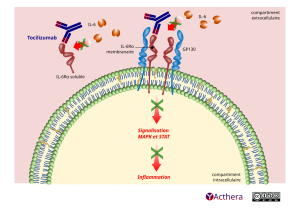
Mécanisme d'action :
Le rôle de l'IL-6 a été mis en évidence dans la pathogenèse de maladies inflammatoires. Le tocilizumab se fixe sur la chaîne α du récepteur à l'IL-6 lorsqu'il est membranaire ou soluble et empêche la cascade de signalisation intracellulaire, limitant ainsi l'activation des gènes inflammatoires.
Effets indésirables les plus fréquents: infections respiratoires hautes, augmentation possible du taux de cholestérol dans le sang.
/!\ Excipients différents par rapport au RoActemra
Contre-indications : hypersensibilité au médicament, infection sévère
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est longue (8 à 14 jours en moyenne).
Utilisation chez la femme enceinte : Au niveau malformatif, les données publiées chez les femmes exposées au tocilizumab au 1er trimestre de grossesse sont peu nombreuses mais aucun élément inquiétant n'est signalé à ce jour. Le tocilizumab n’est pas tératogène chez le singe. Les données publiées chez les femmes enceintes exposées au tocilizumab au 2ème et/ou 3ème trimestres de la grossesse sont très peu nombreuses, mais aucun effet fœtal ou néonatal particulier n’a été signalé à ce jour. Donc on conseille une consultation pré-conceptionnelle pour faire le point sur la pathologie. Le tocilizumab peut être poursuivi pendant la grossesse en tenant compte du risque de l'immunosuppression du traitement.
Le passage du tocilizumab dans le lait est négligeable. Aucun évènement particulier n’a été rapporté chez les enfants allaités par des mères sous tocilizumab et suivis durant 11 mois (petit effectif). Au vu de ces éléments, l’utilisation du tocilizumab est envisageable chez une femme qui allaite.
Selon RCP, les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement, jusqu'à 3 mois après l'arrêt du traitement.
Principales références :
- Abidi E, El Nekidy WS, Alefishat E, Rahman N, Petroianu GA, El-Lababidi R, Mallat J. Tocilizumab and COVID-19: Timing of Administration and Efficacy. Front Pharmacol. 2022 Feb 18;13:825749. doi: 10.3389/fphar.2022.825749. PMID: 35250575; PMCID: PMC8894855.
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- HeTOP
- Meddispar - pas de données au 3 mars 2024
- Vidal
- CRAT
Remarque :
Création de la fiche : Mars 2024
Dernière mise à jour : Avril 2024
Par : Mathilde Glaziou