Tafasitamab (MINJUVI®)
Autres noms : tafasitamab-cxix; MONJUVI®
Structure : IgG1/2 kappa humanisée avec Fc modifié (substitution de 2 acides aminés dans la région Fc, résultant dans une meilleure affinité pour le FcgammaR)
Code ATC : L01XC35
Nomenclature Ge : IgG1κ G1e12
Cible: CD19
Mode de production : produit dans des cellules de mammifère (ovaire de hamster chinois) par la technologie de l’ADN recombinant
Forme galénique : flacon de poudre contenant 200 mg de tafasitamab pour solution à diluer pour perfusion
Mode d'administration : IV
Date de la première AMM : EMA Aout 2021 / FDA juillet 2020
Laboratoires : Incyte Biosciences Distribution B.V.
Indications : en association avec le lénalidomide, suivi par MINJUVI en monothérapie pour le traitement des patients adultes atteints d’un lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire, qui ne sont pas éligibles à une autogreffe de cellules souches hématopoïétiques (CSH)
Prix indicatif (année) : XXX
Posologies : La dose recommandée de MINJUVI est de 12 mg/kg de masse corporelle, administrée par perfusion intraveineuse selon le schéma suivant :
• Cycle 1 : administrer la perfusion les jours 1, 4, 8, 15 et 22 du cycle.
• Cycles 2 et 3 : administrer la perfusion les jours 1, 8, 15 et 22 de chaque cycle.
• Du cycle 4 jusqu’à la progression de la maladie : administrer la perfusion les jours 1 et 15 de chaque cycle.
Chaque cycle dure 28 jours.
De plus, les patients doivent s’auto-administrer des gélules de lénalidomide à la dose initiale recommandée de 25 mg par jour les jours 1 à 21 de chaque cycle. La dose initiale et la posologie ultérieure peuvent être ajustées conformément au résumé des caractéristiques du produit (RCP) du lénalidomide.
L’association MINJUVI plus lénalidomide est administrée pour un maximum de douze cycles.
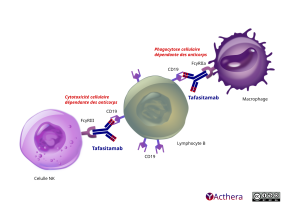
Mécanisme d'action :
Le tafasitamab est un anticorps monoclonal avec fragment Fc amélioré, qui cible l’antigène CD19 exprimé à la surface des lymphocytes pré-B et B matures. Lors de la liaison au CD19, le tafasitamab provoque la lyse des cellules B par :
• l'engagement de cellules immunitaires effectrices telles que les cellules tueuses naturelles (NK), les cellules T γδ et les phagocytes
• l’induction directe de la mort cellulaire (apoptose)
La modification du fragment Fc entraîne une augmentation de la cytotoxicité cellulaire dépendante des anticorps (ADCC) et de la phagocytose cellulaire dépendante des anticorps (ADCP).
Effets indésirables les plus fréquents : infections (73 %), neutropénie (51 %), asthénie (38 %), anémie (36 %), diarrhée (36 %), thrombocytopénie (31 %), toux (26 %), oedème périphérique (24 %), pyrexie (24 %), diminution de l’appétit (22 %) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Hoy SM. Tafasitamab: First Approval. Drugs. 2020 Nov;80(16):1731-1737. doi: 10.1007/s40265-020-01405-w. PMID: 32946059.
- Salles G, Długosz-Danecka M, Ghesquières H, Jurczak W. Tafasitamab for the treatment of relapsed or refractory diffuse large B-cell lymphoma. Expert Opin Biol Ther. 2021 Apr;21(4):455-463. doi: 10.1080/14712598.2021.1884677. Epub 2021 Feb 15. PMID: 33554668; PMCID: PMC8363059.
- Salles G, Duell J, González Barca E, Tournilhac O, Jurczak W, Liberati AM, Nagy Z, Obr A, Gaidano G, André M, Kalakonda N, Dreyling M, Weirather J, Dirnberger-Hertweck M, Ambarkhane S, Fingerle-Rowson G, Maddocks K. Tafasitamab plus lenalidomide in relapsed or refractory diffuse large B-cell lymphoma (L-MIND): a multicentre, prospective, single-arm, phase 2 study. Lancet Oncol. 2020 Jul;21(7):978-988. doi: 10.1016/S1470-2045(20)30225-4. Epub 2020 Jun 5. PMID: 32511983.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas disponible au 20 mai 2022)
- ANSM
- Meddispar (pas disponible au 20 mai 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 20 mai 2022)
- HeTOP[2]
Remarque :
Dernière mise à jour : 20 mai 2022
Relecture par : Pr C. Carnoy