Benralizumab (FASENRA®)
Structure : AcM humanisé IgG1, kappa
Code ATC : R03DX10
Nomenclature Ge : IgG1κ G1e4
Cible: Chaine α du récepteur à l'IL-5 (IL-5Rα)
Mode de production : Ac produit dans des cellules ovariennes de hamster chinois (CHO) par la technologie de l’ADN recombinant
Forme galénique : Solution injectable en seringue préremplie ou en stylo prérempli (auto-injection) de 30 mg
Mode d'administration : SC
Conservation : A conserver au réfrigérateur (entre 2°C et 8°C). Fasenra peut être conservé à température ambiante jusqu'à 25°C pendant un maximum de 14 jours. Après sa sortie du réfrigérateur, Fasenra doit être utilisé dans les 14 jours ou jeté.
Date de la première AMM : FDA 2017 / EMA Janvier 2018
Laboratoire : ASTRAZENECA
Indications : Adulte en traitement de fond additionnel de l'asthme sévère à éosinophiles non contrôlé malgré une corticothérapie inhalée à forte dose associée à des β-agonistes de longue durée d'action.
Critère de prise en charge par la sécurité sociale :
Taux d'éosinophiles > ou égal à 150 /µL à l'instauration du traitement
Au moins 2 épisodes d'exacerbation asthmatique ayant nécessité un traitement par corticoïde oral (≥ 3 jours chacun) dans les 12 derniers mois malgré un traitement de fond associant des corticoïdes inhalés à dose élevée et un bronchodilatateur d'action longue ou un traitement par corticothérapie orale pendant au moins 6 mois au cours des 12 derniers mois.
Granulomatose éosinophilique avec polyangéite (GEPA)
Fasenra est indiqué chez l'adulte en traitement additionnel des formes récidivantes ou réfractaires de la granulomatose éosinophilique avec polyangéite.
Prix indicatif : 1996,42 € (2023) pour 1 seringue préremplie ou 1 stylo prérempli.
Usage : Prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en pneumologie ou allergologie. Disponible à l'officine.
Posologies : 30 mg par injection sous-cutanée une fois toutes les 4 semaines pour les 3 premières doses, puis une fois toutes les 8 semaines par la suite.
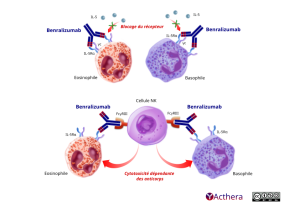
Mécanisme d'action :
Benralizumab cible les cellules effectrices de l'IL-5 (éosinophiles et basophiles) impliquées dans la réaction asthmatique, plutôt que l'IL-5 elle-même comme mepolizumab (NUCALA) et reslizumab (CINQAERO). L'absence de fucose dans le fragment Fc du benralizumab se traduit par une affinité élevée pour les récepteurs FcɣRIII présents à la surface des cellules immunitaires effectrices, telles que les cellules tueuses naturelles (NK). Cela provoque l'apoptose des éosinophiles et des basophiles par cytotoxicité cellulaire dépendante des anticorps (ADCC) accrue, qui réduit l'inflammation éosinophilique
Effets indésirables les plus fréquents: céphalées, pharyngites. Des réactions anaphylactiques ont été rapportées.
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients
Principales références :
Kavanagh JE et al., Chest. 2021, doi : 10.1016/j.chest.2020.08.2083
Miralles López JC, Escudero Pastor AI, Carbonell Martínez A, Navarro Garrido C, Bonilla Pacheco Y, Petrik Petrik Y. Benralizumab in Real Life. J Investig Allergol Clin Immunol. 2021 Feb 17;31(1):87-88. doi: 10.18176/jiaci.0599. Epub 2020 Jun 23. PMID: 32573458.
Liens
- Human medicine European public assessment report (EPAR)
- IMGT
- FDA
- Avis de la HAS sur Fasenra
- fiche info de la base de données publique des médicaments
- HeTOP
- Vidal
- CRAT (pas de données au 13/01/24)
- Vidéos d'aide à l'administration du benralizumab en stylo et en seringue (français)
Remarque :
Dernière mise à jour : Janvier 2024
Relecture par : Dr Patricia De Nadai, Mathilde Glaziou