Pertuzumab (PERJETA®)
Autre nom : OMNITARG®
Structure : AcM humanisé, IgG1k
Code ATC : L01XC13
Nomenclature Ge : IgG1κ G1e0
Cible: HER-2 (human epidermal growth factor receptor 2)
Mode de production : Produit par une culture de cellules de mammifère (ovaire de hamster chinois), par la technique de l’ADN recombinant.
Forme galénique : Solution à diluer pour perfusion de 420 mg (30 mg/mL)
Mode d'administration : IV
Conservation :
Le flacon fermé se conserve 2 ans entre 2 et 8°C au réfrigérateur.
La stabilité physique et chimique du médicament après dilution a été démontrée pendant 24 heures à 30 °C et pendant 30 jours entre 2°C et 8°C à l’abri de la lumière.
Toutefois, d’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les conditions et les durées de conservation après dilution et jusqu’à l’utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures entre 2°C et 8°C, sauf si la dilution a été effectuée dans des conditions d’asepsie dûment contrôlées et validées.
Date de la première AMM : EMA 2013 / FDA 2012
Laboratoires : Genentech / Roche
Indications :
- Cancer du sein précoce :
Traitement néoadjuvant de patients adultes atteints d'un cancer du sein HER2 positif localement avancé, inflammatoire ou à un stade précoce avec un risque élevé de récidive, en association au trastuzumab et à une chimiothérapie.
Traitement adjuvant de patients adultes atteints d'un cancer du sein précoce HER2 positif avec un risque élevé de récidive
- Cancer du sein métastatique :
En association au trastuzumab et au docétaxel, dans le traitement de patients adultes atteints d’un cancer du sein métastatique ou localement récidivant non résécable HER2 positif, n’ayant pas reçu au préalable de traitement anti-HER2 ou de chimiothérapie pour leur maladie métastatique.
Prix indicatif : 351,61€ pour 420 mg de pertuzumab (2013)
Usage : réservé à l'usage hospitalier
Posologies : Dose de charge initiale de 840 mg administrée en IV de 60 minutes, suivie toutes les trois semaines d'une dose d'entretien de 420 mg administrée sur une période de 30 à 60 minutes. Les perfusions suivantes de trastuzumab ou d’une chimiothérapie ne peuvent être réalisées qu’après la fin de la période d’observation
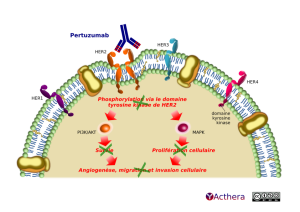
Mécanisme d'action :
Le pertuzumab inhibe la dimérisation de HER2 avec d'autres récepteurs de la famille des HER. Cette inhibition se fait par blocage stérique de la boucle de dimérisation de HER2, au niveau du domaine extracellulaire. Le pertuzumab est cytotoxique également par son mécanisme d'ADCC (cytotoxicité dépendante des anticorps).
Effets indésirables les plus fréquents: infections respiratoires (rhinopharyngite, toux...), neutropénie, anémie, leucopénie, réaction à la perfusion, diminution de l'appétit, insomnie, neuropathie périphérique, céphalées, dysgueusie, étourdissements, augmentation de sécrétions lacrimales, bouffées de chaleur, diarrhées/vomissements, alopécie, rash, sécheresse cutanée, arthralgie et myalgie, fatigue.
Contre-indications : hypersensibilité à une des substances du médicament.
Utilisation chez la femme enceinte :
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par Perjeta et pendant 6 mois après la dernière dose de pertuzumab. Il existe des données limitées sur l’utilisation du pertuzumab chez la femme enceinte. Les études chez l’animal ont mises en évidence une toxicité sur la reproduction. Perjeta n’est donc pas recommandé pendant la grossesse et chez la femme en âge de procréer n’utilisant pas de contraception
Principales références :
- (Baselga et al., 2012), (Johnson and Jänne, 2006), (Hubbard, 2005)
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Perjeta
- IMGT/DB
- Lien vers la monographie de la FDA
- Base de données publique des médicaments
- Meddispar - pas de données au 06/04/23
- CRAT - pas de données au 06/04/23
- Vidal
- HeTop
Remarque :
Dernière mise à jour : Avril 2023
Par : Mathilde GLAZIOU