Ocrelizumab (OCREVUS®)
Structure : IgG1 humanisé
Code ATC : L04AA36
Nomenclature Ge : IgG1κ G1e0
Cible: CD20
Mode de production : Produit dans des cellules d’ovaire de hamster chinois par la technologie de l’ADN recombinant.
Forme galénique : Solution à diluer pour dilution 300 mg dans 10 mL (30 mg/mL)
Mode d'administration : IV
Conservation :
Le flacon se conserve fermé pendant 2 ans au réfrigérateur entre 2 et 8°C.
La stabilité chimique et physique de la solution diluée est de 24 heures à une température comprise entre 2 °C et 8 °C puis de 8 heures à température ambiante.
D’un point de vue microbiologique, la solution préparée doit être utilisée immédiatement. Si la solution n’est pas utilisée immédiatement, la durée et les conditions de conservation avant l’utilisation relèvent de la responsabilité de l’utilisateur et ne doivent pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C puis 8 heures à température ambiante, sauf si la dilution est effectuée dans des conditions aseptiques contrôlées et validées.
Date de la première AMM : EMA 2018 / FDA 2017
Laboratoire : Roche Registration GmbH
Indications :
- Traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou d'imagerie
- Traitement des patients adultes atteints de sclérose en plaques primaire progressive (SEP-PP) à un stade précoce en termes de durée de la maladie et de niveau du handicap, associé à des données d'imagerie caractéristiques d'une activité inflammatoire.
Prix indicatif : 5425 euros le flacon de 10 mL
Usage : Médicament réservé à l'usage hospitalier. Prescription réservée aux spécialistes en neurologie.
Posologies :
- La dose initiale est de 600 mg, administrée en deux perfusions intraveineuses séparées ; une première perfusion de 300 mg, suivie 2 semaines plus tard d’une seconde perfusion de 300 mg
- Les doses suivantes d’ocrelizumab sont administrées en perfusion intraveineuse unique de 600 mg tous les 6 mois (la dose suivant la dose initiale est administrée 6 mois après la première perfusion de 300 mg).
/!\ Recommandation d'une prémédication par anti-histaminique, cortisone et antipyrétique
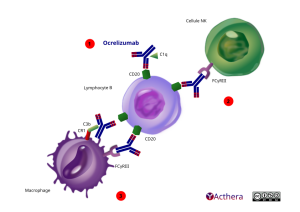
Mécanisme d'action :
Les mécanismes précis par lesquels ocrelizumab exerce ses effets cliniques thérapeutiques dans la SEP ne sont pas complètement élucidés, mais il est supposé qu'ils impliquent une immunomodulation par la réduction du nombre et de la fonction des lymphocytes B exprimant le CD20. Après liaison à la surface cellulaire, ocrelizumab entraîne une déplétion sélective en lymphocytes B exprimant le CD20 par phagocytose cellulaire dépendante des anticorps (antibody-dependent cellular phagocytosis, ADCP), cytotoxicité cellulaire dépendante des anticorps (antibody-dependent cellular cytotoxicity, ADCC), cytotoxicité dépendante du complément (complement-dependent cytotoxicity, CDC) et apoptose. La capacité de reconstitution des lymphocytes B et l'immunité humorale préexistante sont préservées.
Effets indésirables les plus fréquents : Infections, diminution du taux sanguin d'IgM, réactions liées à la perfusion, neutropénie.
Contre-indications : Hypersensibilité à un constituant du médicament, infection active en cours, patient présentant un déficit immunitaire sévère, affections malignes évolutives connues.
Elimination du médicament : Sa demi-vie d’élimination plasmatique est longue (26 jours en moyenne). Il s’élimine donc du plasma en 19 semaines (4.5 mois) environ.
Utilisation chez la femme enceinte :
Les femmes en âge de procréer doivent utiliser une contraception pendant le traitement par ocrelizumab et durant les 12 mois qui suivent la dernière perfusion d’ocrelizumab.
Il n’y a pas de donnée sur le passage placentaire de l’ocrélizumab chez l’humain. Cependant, par analogie avec les IgG1 natives, il y a tout lieu de penser que le passage placentaire de l’ocrélizumab commence à partir de 14 semaines d’aménorrhée (SA) environ, c’est-à-dire après la fin de l’organogenèse.
Les données publiées chez les femmes enceintes exposées à l’ocrélizumab au 1er trimestre de la grossesse sont très peu nombreuses, mais aucun élément inquiétant n’a été signalé à ce jour.
Les données publiées chez les femmes enceintes exposées à l’ocrélizumab au 2ème et/ou 3ème trimestres de la grossesse sont quasi inexistantes. Une lymphopénie B réversible a été observée chez l’un des deux nouveau-nés de mère traitée par ocrélizumab au 2ème trimestre de la grossesse
Du fait de l’immunosuppression induite par le traitement, un risque accru d’infections materno-fœtales est théoriquement possible chez les femmes enceintes traitées par ocrélizumab (listériose, CMV, toxoplasmose…).
Principales références :
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Ocrevus
- Lien vers la monographie de la FDA
- Base de données publique des médicaments
- Meddispar - pas de données au 30/03/23
- Centre de référence sur les agents tératogènes (CRAT)
- Vidal
- IMGT/DB
Remarque :
Dernière mise à jour : Mars 2023
Par : Mathilde GLAZIOU