Satralizumab (ENSPRYNG®)
Structure : AcM humanisé de type IgG2, kappa
Code ATC : L04AC19 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AC Inhibiteurs d'interleukine L04AC19 Satralizumab)
Nomenclature Ge : IgG1κ G2e3
Cible: IL-6R
Mode de production : Le satralizumab est produit dans des cellules ovariennes de hamster chinois par la technologie de l’ADN recombinant.
Forme galénique : Chaque flacon contient 120 mg de satralizumab dans 1 mL (solution injectable en seringue pré-remplie). La solution est incolore à légèrement jaune.
Mode d'administration : SC (seringues pré-remplies)
Conservation : À conserver au réfrigérateur (entre 2°C et 8°C). Ne pas utiliser la seringue si elle a été congelée. Conserver toujours la seringue au sec. A condition qu’elle ne soit pas ouverte et soit conservée dans l’emballage extérieur, la seringue peut être laissée hors du réfrigérateur à une température inférieure à 30°C pendant une période unique pouvant aller jusqu’à 8 jours. Après conservation à température ambiante, le produit ne doit pas être remis au réfrigérateur et doit être utilisé ou jeté.
Date de la première AMM : EMA 2021 / FDA 2020
Laboratoires : Roche Registration GmbH
Indications : Enspryng® est indiqué en monothérapie ou en association avec un traitement immunosuppresseur dans le traitement des troubles du spectre de la neuromyélite optique (TSNMO) chez les patients adultes et les adolescents à partir de 12 ans qui sont séropositifs pour les IgG anti-aquaporine-4 (AQP4-IgG) et atteints de la forme récurrente de la maladie et en échec des traitements de fond immunosuppresseurs (rituximab, azathioprine, mycophénolate mofétil).
Usage : La prescription est hospitalière et restreinte aux neurologues et aux neuropédiatres. Disponible en ville.
Prix (mai 2023) : 8403,63 euros la seringue de 120 mg.
Posologies : Enspryng® peut être utilisé en monothérapie ou en association avec des corticoïdes oraux (CO), de l’azathioprine (AZA), ou du mycophénolate mofétil (MMF).
La posologie recommandée pour la dose de charge est de 120 mg par injection sous-cutanée (SC) toutes les 2 semaines pour les 3 premières administrations (première dose à la Semaine 0, deuxième dose à la Semaine 2 et troisième dose à la Semaine 4).
La posologie recommandée pour la dose d’entretien est de 120 mg par injection SC toutes les quatre semaines.
Au total : 120mg à S0, S2, S4 puis 120mg toutes les 4 semaines.
La posologie chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg et chez les patients adultes est identique.
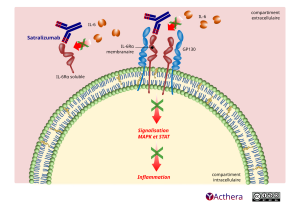
Mécanisme d'action :
Le satralizumab est un anticorps monoclonal (AcM) recombinant humanisé de type immunoglobuline G2 (IgG2) qui se lie aux récepteurs solubles et transmembranaires de l’IL-6 (IL-6R) humaine, et empêche donc la voie de signalisation en aval de l’IL-6 grâce à ces récepteurs. Les taux d’IL-6 augmentent dans le liquide céphalorachidien et le sérum des patients atteints de NMO et de TSNMO pendant les périodes d’activité de la maladie. Les fonctions de l’IL-6 ont été impliquées dans la pathogenèse de la NMO et des TNSMO, incluant l’activation des lymphocytes B, la différenciation des lymphocytes B en plasmablastes et la production d’auto-anticorps spécifiques à la pathologie, par exemple dirigés contre l’AQP4, une protéine formant un canal pour l’eau, exprimée principalement par les astrocytes dans le SNC, l’activation et la différenciation des cellules Th17, l’inhibition de lymphocytes T régulateurs, et les modifications de la perméabilité de la barrière hémato-encéphalique.
Effets indésirables les plus fréquents : Céphalées, hyperlipidémie, arthralgie, réactions au point d'injection
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
Remarque :
Dernière mise à jour : 01/23
Par : Mathilde GLAZIOU