Efgartigimod alfa (VYVGART®)
Autres noms : efgartigimod alfa-fcab
Structure : fragment Fc dérivé d’une immunoglobuline G1 (IgG1) recombinante humaine
Code ATC : L04AA58
Nomenclature Ge : xxx
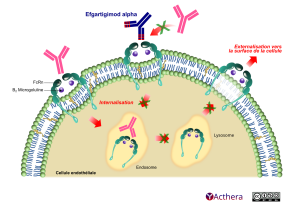
Cible: Récepteur néonatal Fc (FcRn)
Mode de production : Protéine recombinante humaine issue de cellules d’ovaires de hamster chinois (CHO) par la technologie de l’ADN recombinant
Forme galénique : Flacon de 20 mL contenant 400 mg d’efgartigimod alfa (20 mg/mL). Solution à diluer pour perfusion
Mode d'administration : iv
Date de la première AMM : EMA aout 2022 / FDA 2021
Laboratoires et lien vers xxx: Argenx
Indications : Efgartigimod alfa est indiqué en association au traitement standard chez les patients adultes atteints de myasthénie auto-immune généralisée et présentant des anticorps anti-récepteurs de l’acétylcholine (RACh).
Prix indicatif (2024) : 14 838,32 euros le flacon de 5,6 ml
Posologies :
La dose recommandée est de 10 mg/kg en perfusion intraveineuse d’une heure, à administrer par cycles d’une perfusion hebdomadaire pendant 4 semaines. Les cycles de traitement suivants doivent être administrés en fonction de l’évaluation clinique. La fréquence des cycles de traitement peut varier d’un patient à l’autre
Mécanisme d'action :
L’efgartigimod alfa est un fragment d’anticorps IgG1 humain conçu pour renforcer l’affinité avec le récepteur néonatal Fc (FcRn). L’efgartigimod alfa se lie au FcRn, ce qui entraîne une diminution des taux d’IgG circulantes, y compris les auto-anticorps IgG pathogènes. L’efgartigimod alfa n’a pas d’impact sur les taux des autres immunoglobulines (IgA, IgD, IgE ou IgM) et ne réduit pas les taux d’albumine. Les auto-anticorps IgG sont la cause sous-jacente de la pathogenèse de la myasthénie auto-immune. Ils affectent la transmission neuromusculaire en se liant aux récepteurs de l’acétylcholine (RACh), aux récepteurs tyrosine kinase spécifiques du muscle (MuSK) ou à la protéine 4 des récepteurs des lipoprotéines de basse densité (LRP4)
Effets indésirables les plus fréquents : Infections des voies aériennes supérieures et les infections des voies urinaires (10,7 % et 9,5 %, respectivement) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Saccà F, Barnett C, Vu T, Peric S, Phillips GA, Zhao S, Qi CZ, Gelinas D, Chiroli S, Verschuuren JJGM. Efgartigimod improved health-related quality of life in generalized myasthenia gravis: results from a randomized, double-blind, placebo-controlled, phase 3 study (ADAPT). J Neurol. 2023 Apr;270(4):2096-2105. doi: 10.1007/s00415-022-11517-w. Epub 2023 Jan 4. PMID: 36598575; PMCID: PMC10025199.
- Heo YA. Efgartigimod: First Approval. Drugs. 2022 Feb;82(3):341-348. doi: 10.1007/s40265-022-01678-3. Erratum in: Drugs. 2022 Apr;82(5):611. PMID: 35179720; PMCID: PMC8855644.
- Howard JF Jr, Bril V, Vu T, Karam C, Peric S, Margania T, Murai H, Bilinska M, Shakarishvili R, Smilowski M, Guglietta A, Ulrichts P, Vangeneugden T, Utsugisawa K, Verschuuren J, Mantegazza R; ADAPT Investigator Study Group. Safety, efficacy, and tolerability of efgartigimod in patients with generalised myasthenia gravis (ADAPT): a multicentre, randomised, placebo-controlled, phase 3 trial. Lancet Neurol. 2021 Jul;20(7):526-536. doi: 10.1016/S1474-4422(21)00159-9. Erratum in: Lancet Neurol. 2021 Aug;20(8):e5. PMID: 34146511.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments : VYVGART 20 mg/mL
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 7 juin 2024
Relecture par :