Inotuzumab ozogamicin (BESPONSA®)
Structure : AcM humanisé (IgG4) lié au N-acétyl-gamma-calichéamicine diméthylhydrazide
Code ATC : L01FX06
Nomenclature Ge : IgG4κ G4e1 conjuguée
Cible: CD22
Mode d'administration : IV
Date de la première AMM : EMA Juin 2017 / FDA Aout 2017
Laboratoires : Pfizer
Indications :
- Patients adultes présentant une leucémie aiguë lymphoblastique (LAL) à précurseurs B, d'expression positive du CD22 en rechute ou réfractaire.
- Patients adultes présentant une LAL à précurseurs B en rechute ou réfractaire, avec chromosome Philadelphie positif (Ph+) doivent avoir subi un échec de traitement avec au moins 1 inhibiteur de la tyrosine kinase (ITK)
Prix indicatif :
Usage : hospitalier
Posologies : L'administration de BESPONSA doit être effectuée par cycles de 3 à 4 semaines. Pour les patients éligibles à une greffe de cellules souches hématopoïétiques (GCSH), la durée de traitement recommandée est de 2 cycles. Pour le premier cycle, la dose totale recommandée de BESPONSA est de 1,8 mg/m2 par cycle pour tous les patients, administrée en 3 doses fractionnées les jours J1 (0,8 mg/m2), J8 (0,5 mg/m2) et J15 (0,5 mg/m2). Le Cycle 1 s'étend sur 3 semaines mais cette durée peut être étendue à 4 semaines si le patient obtient une rémission complète (RC) ou une rémission complète avec récupération hématologique partielle (RCh), et/ou pour permettre une résolution d'une toxicité. Pour les cycles suivants, la dose totale recommandée de BESPONSA est de 1,5 mg/m2 par cycle, administrée en 3 doses fractionnées les jours J1 (0,5 mg/m2), J8 (0,5 mg/m2) et J15 (0,5 mg/m2) pour les patients obtenant une RC/RCh ; ou de 1,8 mg/m2 par cycle, administrée en 3 doses fractionnées aux jours J1 (0,8 mg/m2), J8 (0,5 mg/m2) et J15 (0,5 mg/m2) pour les patients n'obtenant pas une RC/RCh. Les cycles suivants durent 4 semaines.
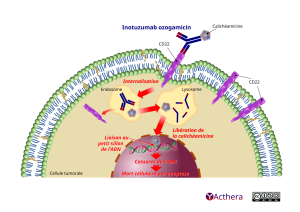
Mécanisme d'action :
La N-acétyl-gamma-calichéamicine est liée par covalence à l'anticorps via un agent de liaison dissociable par un acide. L'activité anticancéreuse de BESPONSA est due à la liaison de l'anticorps conjugué aux cellules tumorales exprimant le CD22, suivie par l'internalisation du complexe anticorps conjugué-CD22, et par la libération intracellulaire du N-acétyl-gammacalichéamicine diméthylhydrazide par le clivage hydrolytique de l'agent de liaison. L'activation du N-acétyl-gamma-calichéamicine diméthylhydrazide cause des ruptures des doubles brins d'ADN, induisant par la suite un arrêt du cycle cellulaire et une mort cellulaire apoptotique
Effets indésirables les plus fréquents: thrombopénie (51 %), neutropénie (49 %), infection (48 %), anémie (36 %), leucopénie (35 %), fatigue (35 %)
Contre-indications : -
- Hypersensibilité à la substance active ou à l’un des excipients
- Patients présentant des antécédents de maladie veino-occlusive hépatique/syndrome d’obstruction sinusoïdale (MVO/SOS) sévère ou évolutive confirmée.
- Patients présentant une maladie hépatique évolutive grave (par ex., cirrhose, hyperplasie régénérative nodulaire, hépatite active).
Principales références :
- DeAngelo DJ, Advani AS, Marks DI, Stelljes M, Liedtke M, Stock W, Gökbuget N, Jabbour E, Merchant A, Wang T, Vandendries E, Neuhof A, Kantarjian H, O'Brien S. Inotuzumab ozogamicin for relapsed/refractory acute lymphoblastic leukemia: outcomes by disease burden. Blood Cancer J. 2020 Aug 7;10(8):81. doi: 10.1038/s41408-020-00345-8. PMID: 32769965; PMCID: PMC7414105.
- Lamb YN. Inotuzumab Ozogamicin: First Global Approval. Drugs. 2017 Sep;77(14):1603-1610. doi: 10.1007/s40265-017-0802-5. PMID: 28819740.
- Kantarjian HM, DeAngelo DJ, Stelljes M, Martinelli G, Liedtke M, Stock W, Gökbuget N, O'Brien S, Wang K, Wang T, Paccagnella ML, Sleight B, Vandendries E, Advani AS. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med. 2016 Aug 25;375(8):740-53. doi: 10.1056/NEJMoa1509277. Epub 2016 Jun 12. PMID: 27292104; PMCID: PMC5594743.
- Kantarjian HM, DeAngelo DJ, Stelljes M, Liedtke M, Stock W, Gökbuget N, O'Brien SM, Jabbour E, Wang T, Liang White J, Sleight B, Vandendries E, Advani AS. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INO-VATE study. Cancer. 2019 Jul 15;125(14):2474-2487. doi: 10.1002/cncr.32116. Epub 2019 Mar 28. PMID: 30920645; PMCID: PMC6618133.
- Jabbour E, Sasaki K, Short NJ, Ravandi F, Huang X, Khoury JD, Kanagal-Shamanna R, Jorgensen J, Khouri IF, Kebriaei P, Jain N, Alvarado Y, Kadia TM, Paul S, Garcia-Manero G, Dabaja BS, Burger JA, DiNardo CD, Daver NA, Montalban-Bravo G, Yilmaz M, Ohanian M, Ferrajoli A, Jacob J, Rostykus M, Garris R, O'Brien S, Kantarjian HM. Long-term follow-up of salvage therapy using a combination of inotuzumab ozogamicin and mini-hyper-CVD with or without blinatumomab in relapsed/refractory Philadelphia chromosome-negative acute lymphoblastic leukemia. Cancer. 2021 Jun 15;127(12):2025-2038. doi: 10.1002/cncr.33469. Epub 2021 Mar 19. PMID: 33740268.
- Paul S, Rausch CR, Kantarjian H, Jabbour EJ. Treatment of adult acute lymphoblastic leukemia with inotuzumab ozogamicin. Future Oncol. 2017 Oct;13(25):2233-2242. doi: 10.2217/fon-2017-0233. Epub 2017 Aug 4. PMID: 28776425.
Liens :
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Besponsa
- Base de données publique des médicaments
- ANSM (pas de données au 6 juillet 2023)
- Meddispar (pas de données au 6 juillet 2023)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 6 juillet 2023)
- IMGT
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 6 juillet 2023
Relecture par :