Abciximab (REOPRO®)
Attention :
Cette spécialité n’est plus commercialisée depuis le 16-01-2019
Structure : Fragment Fab d'un anticorps monoclonal chimérique, IgG1k
Cible: GPIIb/IIIa
Code ATC : BO1AC13
Mode de production : xx
Forme galénique : 2mg/ml en solution injectable ou pour perfusion
Mode d'administration : IV
Date de la première AMM : EMA retiré / FDA 1994
Laboratoires : JANSSEN BIOLOGICS B.V. (anciennement Centocor B.V / Lilly France)
Indications : utilisé en complément de l'administration d'héparine et d'acide acétylsalicylique dans
- Intervention coronarienne percutanée
Prévention des complications cardiaques ischémiques chez les patients qui font l'objet d'une intervention coronarienne percutanée (angioplastie à ballonnet, athérectomie et pose d'un stent) (voir rubrique Pharmacodynamie).
- Angor instable
Réduction à court terme (1 mois) du risque d'infarctus du myocarde chez les patients souffrant d'angor instable réfractaire au traitement médical conventionnel, chez lesquels une intervention coronarienne percutanée est programmée.
Prix indicatif :
Usage : réservé à l'usage hospitalier et à l'usage en situation d'urgence
Posologies : 0,25 mg/kg suivi immédiatement après d'une perfusion intraveineuse continue de 0,125 µg/kg/min (jusqu'à un maximum de 10 µg/min)
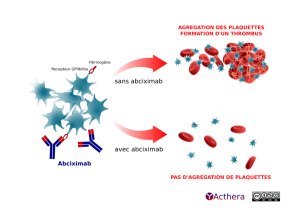
Mécanisme d'action :
L'abciximab inhibe l'agrégation plaquettaire en empêchant la liaison du fibrinogène et du facteur de Willebrand aux récepteurs GPIIb/IIIa des plaquettes actives. C'est un antagoniste de ces récepteurs. Le but de cet anticorps est de lutter contre la formation de la plaque d'athérome formée par un amas de plaquettes à l'origine d'un thrombus pouvant aboutir à l'occlusion coronaire.
Effets indésirables les plus fréquents: thrombocytopénie, céphalée, bradycardie, nausées, hypotension
Contre-indications : hypersensibilité au médicament, patients à risque hémorragique accru
Principales références : • (Suzuki et al., 2002) (Thiele et al., 2012)
Liens :
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur xxx