Denosumab (PROLIA®, XGEVA®) - Bioréférent
Structure : AcM humain, IgG2
Code ATC : M05BX04
Mode de production : Produit à partir d'une lignée cellulaire de mammifère (cellules d'ovaire de hamster chinois, CHO) par la technique de l'ADN recombinant.
Nomenclature Ge : IgG1κ G2e0
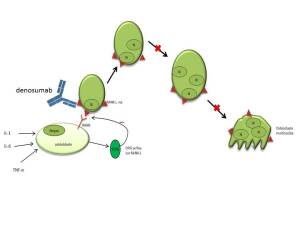
Cible : RANK-L (R activator of nuclear factor x-B ligand)
Forme galénique :
PROLIA : Solution injectable de 1 ml contenant 60 mg de denosumab en seringue préremplie
XGEVA : Solution injectable de 1,7 ml contenant 120 mg de denosumab en flacon
Mode d'administration : SC.
Date de la première AMM : Prolia® FDA 2010 / EMA mai 2010 – Xgeva ® FDA 2012 / EMA juillet 2011
Laboratoires : Amgen
Indications :
Prolia® : Traitement de l'ostéoporose post-ménopausique (FDA & EMA) ; traitement de la perte osseuse chez les patients subissant une ablation hormonale pour cancer de la prostate (EMA) ; traitement de la perte osseuse associée à un traitement systémique à long terme par glucocorticoïdes chez les patients adultes à risque élevé de fractures.
Xgeva® : Prévention des complications osseuses (fractures pathologiques, irradiation osseuse, compression médullaire ou chirurgie osseuse) chez des patients adultes atteints de tumeurs solides présentant des métastases osseuses ; traitement des adultes et des adolescents à maturité squelettique atteints de tumeurs osseuses à cellules géantes, non résécables ou pour lesquels la résection chirurgicale est susceptible d'entraîner une morbidité sévère
Prix indicatif :
2020 : 271.7 € le flacon de 120 mg de Xgeva® - 180.56 € la seringue préremplie de 1ml (60 mg) de Prolia®
2013 : 351,61€ pour 120 mg de Xgeva® - 207,16€ pour 60 mg de Prolia®
Usage : réservé à l'usage hospitalier
Posologies :
Prolia® : 60 mg tous les 6 mois
Xgeva® :
- Prévention des complications osseuses chez les patients adultes présentant une affection maligne avancée avec atteinte osseuse : 120 mg, une fois toutes les quatre semaines
- Tumeur osseuse à cellules géantes :120 mg toutes les quatre semaines administrée en une seule injection e, avec une dose supplémentaire de 120 mg aux jours 8 et 15 du premier mois de traitement.
Mécanisme d'action :
Sous l'action de stimuli (interleukine, TNF), les ostéoblastes produisent une protéine nommée RANK-L ou TRANCE et sécrètent l'ostéoprotégérine (OPG), une protéine inhibitrice de RANK-L. Lorsque RANK-L se lie à son récepteur RANK (récepteur qui appartient à la famille du TNFR) il y a induction de la transformation des pré-ostéoclastes en ostéoclastes matures multinuclées. Le dénosumab est dit OPG mimétique puisqu'il inhibe la maturation des ostéoclastes en se liant à RANK-L, empêchant son interaction avec RANK, et protégeant ainsi contre la dégradation de l'os par les ostéoclastes. L'ostéoporose est donc réduite lors du traitement par le dénosumab.
Effets indésirables les plus fréquents:
Prolia : douleurs musculo-squelettiques et douleurs aux extrémités ;
Xgeva : hypocalcémie et douleurs musculo-squelettiques
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients ; Hypocalcémie; Lésions non cicatrisées résultant d'une chirurgie bucco-dentaire
Références :
Bone HG, Wagman RB, Brandi ML, Brown JP, Chapurlat R, Cummings SR, Czerwiński E, Fahrleitner-Pammer A, Kendler DL, Lippuner K, Reginster JY, Roux C, Malouf J, Bradley MN, Daizadeh NS, Wang A, Dakin P, Pannacciulli N, Dempster DW, Papapoulos S. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-523. doi: 10.1016/S2213-8587(17)30138-9. Epub 2017 May 22. PMID: 28546097.
Deeks ED. Denosumab: A Review in Postmenopausal Osteoporosis. Drugs Aging. 2018 Feb;35(2):163-173. doi: 10.1007/s40266-018-0525-7. Erratum in: Drugs Aging. 2018 Mar 9;: PMID: 29435849.
Pang KL, Low NY, Chin KY. A Review on the Role of Denosumab in Fracture Prevention. Drug Des Devel Ther. 2020 Oct 1;14:4029-4051. doi: 10.2147/DDDT.S270829. PMID: 33061307; PMCID: PMC7534845.
- Thèse de pharmacie : Rationnel de la conception de la première biothérapie dans le traitement de l'ostéoporose : le dénosumab, Hélène Kaplon 2014
Liens :
- Avis de la HAS sur Prolia
- Human medicine European public assessment report (EPAR) pour PROLIA
- Human medicine European public assessment report (EPAR) pour XGEVA
- Fiche info de la base de données publique des médicaments pour PROLIA
- Fiche info de la base de données publique des médicaments pour XGEVA
- HeTOP
Remarque :
Dernière mise à jour : 27/07/2021
Relecture par : Dr P. De Nadai