Lebrikizumab (EBGLYSS®)
Autres noms : xxx
Structure : AcM humanizé de type IgG4 kappa
Code ATC : D11AH
Nomenclature Ge : xxx
Cible: IL-13
Mode de production : Produit dans des cellules ovariennes de hamster chinois (CHO) par la technologie de l’ADN recombinant.
Forme galénique : Solution injectable en seringue ou en stylo préremplis (250 mg)
Mode d'administration : SC
Date de la première AMM : EMA novembre 2023 / FDA octobre 2023
Laboratoire : Almirall
Indications :
Dermatite atopique : Traitement indiqué dans le traitement de la dermatite atopique modérée à sévère de l’adulte et de l’adolescent âgé de 12 ans et plus, pesant au moins 40 kg, qui nécessitent un traitement systémique.
Prix indicatif (année) : xxx
Usage : Médicament soumis à prescription médicale restreinte.
Posologies :
La dose recommandée de lébrikizumab est de 500 mg (deux injections de 250 mg) à la semaine 0 et à la semaine 2, suivie de 250 mg administrés par injection sous-cutanée toutes les deux semaines jusqu’à la semaine 16. Une fois la réponse clinique obtenue, la dose d’entretien de lébrikizumab recommandée est de 250 mg toutes les quatre semaines.
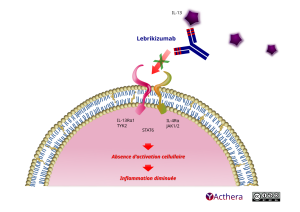
Mécanisme d'action :
Le lébrikizumab est un anticorps monoclonal de type immunoglobuline G4 (IgG4) qui se lie avec une haute affinité à l’interleukine-13 (IL-13) et inhibe sélectivement la signalisation de l’IL-13 par la voie du récepteur alpha de l’IL-4 (IL-4Rα) et de l’hétérodimère du récepteur alpha 1 de l’IL-13 (IL-13Rα1), inhibant ainsi les effets de l’IL-13 en aval. L’inhibition de la signalisation de l’IL-13 devrait être bénéfique dans les maladies pour lesquelles l’IL-13 est un facteur clé de la pathogenèse de la maladie. Le lébrikizumab n’empêche pas la liaison de l’IL-13 au récepteur alpha 2 de l’IL-13 (IL-13Rα2 ou récepteur leurre), ce qui permet l’internalisation de l’IL-13 dans la cellule.
Effets indésirables les plus fréquents : conjonctivites (6,9 %), des réactions au site d’injection (2,6 %), des conjonctivites allergiques (1,8 %) et une sécheresse oculaire (1,4 %) (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients.
Principales références :
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments - pas de donnée au 12/07/24
- ANSM - pas de donnée au 12/07/24
- Meddispar - pas de donnée au 12/07/24
- Vidal - pas de donnée au 12/07/24
- Centre de référence sur les agents tératogènes (CRAT) - pas de donnée au 12/07/24
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : Juillet 2024
Relecture par : Mathilde Glaziou