Ibritumomab tiuxétan (ZEVALIN®)
Structure : AcM murin IgG1k couplé à l'Yttrium 90
Code ATC : V10XX02
Nomenclature Ge : xxx
Cible: CD20
Mode de production : Produit par la technologie de l’ADN recombinant dans une lignée de cellules d’ovaire de hamster chinois (CHO) et conjugué au chélateur MX-DTPA.
Forme galénique : Zevalin se présente sous la forme d'une trousse pour la préparation de l'ibritumomab tiuxétan marqué à l'yttrium–90. La trousse contient un flacon d’ibritumomab tiuxétan, un flacon d’acétate de sodium, un flacon de solution tampon et un flacon de réaction vide. Le radionucléide n’est pas un composant de la trousse. Après radiomarquage, la formulation finale contient 2,08 mg d'ibritumomab tiuxétan [90Y] dans un volume de 10 mL.
Mode d'administration : IV
Conservation : Le produit se conserve 66 mois. Il est recommandé d’utiliser la solution immédiatement après le radiomarquage. Sa stabilité physico-chimique a été démontrée pendant 8 heures entre 2°C et 8°C à l'abri de la lumière.
Date de la première AMM : EMA 2004 / FDA 2002
Laboratoires : Biogen IDEC Pharmaceuticals (Cambridge MA USA) Schering AG (Berlin Germany)
Indications :
- traitement de consolidation après induction d’une rémission chez les patients atteints d’un lymphome folliculaire non traités antérieurement.
- traitement des patients adultes atteints d’un lymphome non hodgkinien (LNH) à cellules B CD20+, de type folliculaire, en rechute ou réfractaire après traitement par le rituximab.
Prix indicatif : 11 128,90 euros en 2020.
Usage : réservé à l'usage hospitalier.
Posologies :
Le schéma de traitement consiste en deux administrations intraveineuses de rituximab et une administration de solution de [90Y]–Zevalin selon la séquence suivante :
- Jour 1 : perfusion intraveineuse de 250 mg/m² de rituximab.
- Jour 7 ou 8 ou 9 :
perfusion intraveineuse de 250 mg/m² de rituximab brève (moins de 4 heures) avant administration de la solution de [90Y]–Zevalin
perfusion intraveineuse en 10 minutes de la solution de [90Y]–Zevalin
Sinon, selon le taux de plaquettes ; si la numération plaquettaire est supérieure ou égale à 150 000/mm3, 15 MBq de Zevalin par kg de poids, si la numération plaquettaire est comprise entre 100 000 et 149 000 par mm3, 11 MBq de Zevalin
/!\ Il n'y a pas de données sur l'usage réitéré du médicament.
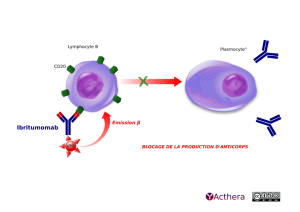
Mécanisme d'action :
L'ibritumomab permet, grâce au radioisotope de tuer les cellules cibles et les cellules cancéreuses à proximité grâce à un rayonnement ß ainsi que par le mécanisme d'ADCC. Ce mécanisme limite la prolifération des lymphocytes B. Il est préférable d'administrer au préalable le rituximab (AcM anti CD20) pour éliminer les lymphocytes B circulants afin de permettre à l'anticorps monoclonal radioactif d'irradier plus spécifiquement les lymphocytes B lymphomateux
Effets indésirables les plus fréquents: neutropénie, leucocytopénie, thrombopénie, anémie, nausées, asthénie, infections, pétéchies.
Contre-indications : hypersensibilité au médicament, grossesse et allaitement
/!\ Ce médicament peut contenir jusqu’à 28 mg de sodium par dose, en fonction de la concentration radioactive : à prendre en compte pour les patients devant faire attention à leur apport en sodium.
Utilisation chez la femme enceinte : Aucune étude animale de reproduction n'a été réalisée avec l'ibritumomab tiuxétan. Compte-tenu du franchissement connu de la barrière placentaire par les IgG et du risque significatif associé à l'irradiation, Zevalin est contre-indiqué chez la femme enceinte. Il convient donc d'exclure toute grossesse en début de traitement. Les femmes et les hommes susceptibles de procréer doivent utiliser une contraception efficace pendant le traitement par Zevalin et jusqu’à 12 mois après le traitement.
Principales références :
- (Morschhauser et al., 2008), (Witzig et al., 2002)
Liens :
- Avis de la HAS du Zevalin
- Lien vers Human medicine European public assessment report (EPAR)
- FDA
- IMGT/DB
- CRAT - pas de données au 28/03/23
- Meddispar - pas de données au 28/03/23
- ANSM - pas de données au 28/03/23
- Vidal
- Base de données publique des médicaments
- HeTop
Remarque :
Dernière mise à jour : Mars 2023
Par : Mathilde GLAZIOU