Eptinezumab (VYEPTI®)
Autres noms : eptinezumab-jjmr
Structure : AcM IgG1 humanisé
Code ATC : N02CD05
Nomenclature Ge : IgG1κ G1e11
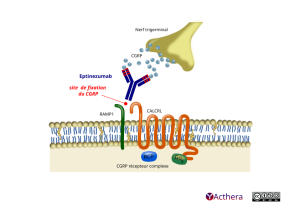
Cible: peptide relié au gène de la calcitonine (calcitonin gene-related peptide, CGRP)
Mode de production : produit dans des cellules de levure Pichia pastoris
Forme galénique : Flacon de solution à diluer pour perfusion contenant 100 mg d’eptinezumab par mL
Mode d'administration : IV (perfusions de 30 minutes)
Conservation : Au réfrigérateur (entre 2 et 8°C). Après dilution, la solution pour perfusion de VYEPTI (solution injectable de chlorure de sodium à 0,9 %) peut être conservée à température ambiante (à une température ne dépassant pas 25 °C) ou au réfrigérateur (entre 2 °C et 8 °C). La solution doit être perfusée dans les 8 heures suivant la dilution.
Date de la première AMM : EMA janvier 2022 / FDA février 2021
Laboratoire : H. Lundbeck A/S
Indications : Prophylaxie de la migraine chez les adultes ayant au moins 4 jours de migraine par mois
Prix indicatif (année) : xxx
Usage : Liste 1, réservé à l'usage hospitalier, prescription restreinte aux spécialistes en neurologie. Remb. uniquement après échec d'au moins 2 médicaments préventifs chez les patients ayant au moins 8 jours de migraines/mois et n'ayant pas d'antécédent CV.
Posologies : La posologie recommandée est de 100 mg en perfusion intraveineuse toutes les 12 semaines. Une posologie de 300 mg en perfusion intraveineuse toutes les 12 semaines peut bénéficier à certains patients. La nécessité d’augmenter la posologie doit être évaluée dans les 12 semaines suivant l’instauration du traitement. Le bénéfice global et l’intérêt de poursuivre le traitement doivent être évalués 6 mois après l’instauration du traitement.
Mécanisme d'action :
L’eptinezumab se lie aux formes α et β du peptide relié au gène de la calcitonine (CGRP, calcitonin gene-related peptide) humain, avec une affinité de l’ordre du picomolaire (Kd de 4 et 3 pM, respectivement). L’eptinezumab empêche l’activation des récepteurs du CGRP et par conséquent, la cascade des événements physiologiques liés au déclenchement de la crise migraineuse. L’eptinezumab inhibe l’inflammation neurogène et la vasodilatation induites par les deux isoformes α et β du CGRP.
Effets indésirables les plus fréquents : rhinopharyngite, hypersensibilité, troubles cardiovasculaires liées à une vasoconstriction tels que l'hypertension artérielle, crises hypertensives, froideurs des extrémités, et syndrome de Raynaud. (se référer au RCP pour avoir la liste complète des effets indésirables).
NB : Sa demie-vie est longue (27 jours) : c'est un inconvénient majeur lors de la survenue d'effets indésirables ou d'interactions médicamenteuses.
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients.
Utilisation chez la femme enceinte : Le rôle du CGRP est évoqué dans la vascularisation du placenta. L'usage de l'eptinezumab paraît donc imprudent, selon la revue Prescrire, chez les femmes enceintes ou qui pourraient le devenir.
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- FDA
- HAS
- Base de données publique des médicaments
- Meddispar : pas de données au 07/05/23
- Centre de référence sur les agents tératogènes (CRAT) : pas de données au 07/05/23
Remarque :
Dernière mise à jour : 05/23
Relecture par : Mathilde GLAZIOU