Ofatumumab (KESIMPTA®)
Attention :
Le 8 novembre 2016, Novartis Europharm Ltd a officiellement notifié au comité des médicaments à usage humain (CHMP) son souhait de retirer sa demande d'utilisation de l'ofatumumab sous le nom commercial d'ARZERRA® dans une association avec la bendamustine pour le traitement de la leucémie lymphoïde chronique (LLC) récidivante.
Structure : AcM humain, IgG1k
Code ATC : L04AA52
Nomenclature Ge : IgG1κ G1e0
Cible: CD20
Mode de production : Produit à partir d’une lignée de cellules murines (NS0) par la technologie de l’ADN recombinant
Forme galénique : solution injectable de 20 mg en seringue préremplie en stylo prérempli. Chaque seringue ou stylo préremplis contient 20 mg d’ofatumumab dans 0,4 ml de solution (50 mg/ml)
Mode d'administration : SC
Date de la première AMM : EMA 03/2021 / FDA 08/2020
Laboratoires : Novartis Pharma SAS (Glaxo Group pour la spécialité ARZERRA)
Indications :
Traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou d’imagerie
Prix indicatif : 1644,91 euros le stylo de 0,4ml (20 mg) (2021)
Usage : Prescription réservée aux spécialistes en neurologie. La première injection doit être effectuée sous la supervision d'un professionnel de santé
Posologies : La dose recommandée est de 20 mg avec une dose initiale aux semaines 0, 1 et 2, suivie d’une dose mensuelle à partir de la semaine 4.
Mécanisme d'action :
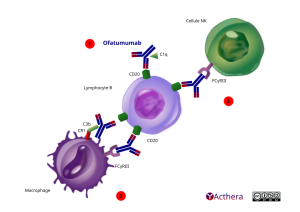
L'ofatumumab est un anticorps monoclonal dirigé contre le CD20 présent sur les LcB. En se liant au CD20 il permet l'activation du complément afin de réaliser une CDC. Il y a également un phénomène d'ADCC mis en place avec les NK. Il agit sur les cellules qui expriment fortement mais aussi faiblement le CD20 et sur les cellules résistantes au rituximab
Effets indésirables les plus fréquents : Infections des voies respiratoires supérieures (39,4 %), les réactions systémiques liées à l'injection (20,6 %), les réactions au site d'injection (10,9 %) et les infections des voies urinaires (11,9 %)
Contre-indications :
Hypersensibilité à la substance active ou à l’un des excipients ; patients présentant un déficit immunitaire sévère ; infection active sévère jusqu’à sa résolution ; affection maligne évolutive connue.
Principales références :
- Kaegi C, Wuest B, Crowley C, Boyman O. Systematic Review of Safety and Efficacy of Second- and Third-Generation CD20-Targeting Biologics in Treating Immune-Mediated Disorders. Front Immunol. 2022 Feb 2;12:788830. doi: 10.3389/fimmu.2021.788830. PMID: 35185862; PMCID: PMC8847774.
- Gärtner J, Hauser SL, Bar-Or A, Montalban X, Cohen JA, Cross AH, Deiva K, Ganjgahi H, Häring DA, Li B, Pingili R, Ramanathan K, Su W, Willi R, Kieseier B, Kappos L. Efficacy and safety of ofatumumab in recently diagnosed, treatment-naive patients with multiple sclerosis: Results from ASCLEPIOS I and II. Mult Scler. 2022 Mar 10:13524585221078825. doi: 10.1177/13524585221078825. Epub ahead of print. PMID: 35266417.
- Hauser SL, Bar-Or A, Cohen JA, Comi G, Correale J, Coyle PK, Cross AH, de Seze J, Leppert D, Montalban X, Selmaj K, Wiendl H, Kerloeguen C, Willi R, Li B, Kakarieka A, Tomic D, Goodyear A, Pingili R, Häring DA, Ramanathan K, Merschhemke M, Kappos L; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246. PMID: 32757523.
- Florou D, Katsara M, Feehan J, Dardiotis E, Apostolopoulos V. Anti-CD20 Agents for Multiple Sclerosis: Spotlight on Ocrelizumab and Ofatumumab. Brain Sci. 2020 Oct 20;10(10):758. doi: 10.3390/brainsci10100758. PMID: 33092190; PMCID: PMC7589300.
- Bar-Or A, Grove RA, Austin DJ, Tolson JM, VanMeter SA, Lewis EW, Derosier FJ, Lopez MC, Kavanagh ST, Miller AE, Sorensen PS. Subcutaneous ofatumumab in patients with relapsing-remitting multiple sclerosis: The MIRROR study. Neurology. 2018 May 15;90(20):e1805-e1814. doi: 10.1212/WNL.0000000000005516. Epub 2018 Apr 25. Erratum in: Neurology. 2018 Sep 11;91(11):538. PMID: 29695594; PMCID: PMC5957306.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
Remarque :
Dernière mise à jour : mars 2022
Relecture par : Pr C. Carnoy