Linvoseltamab (LYNOZYFIC®)
Autre nom : linvoseltamab-gcpt
Structure : AcM humain bispécifique de type IgG4
Code ATC : L01FX
Nomenclature Ge : xxx
Mode de production : produit dans des cellules d’ovaire de hamster chinois (CHO) par la technologie de l’ADN recombinant.
Forme galénique : Solutions à diluer pour perfusion
Flacon LYNOZYFIC 5 mg, contient 5 mg de linvoseltamab dans 2,5 ml à une concentration de 2 mg/ml.
Flacon LYNOZYFIC 200 mg, contient 200 mg de linvoseltamab dans 10 ml à une concentration de 20 mg/ml.
Mode d'administration : IV
Date de la première AMM : FDA XXX / EMA avril 2025
Laboratoire : REGENERON IRELAND DAC
Indications : Adultes atteints d’un myélome multiple en rechute ou réfractaire, ayant reçu au moins 3 traitements antérieurs, incluant un inhibiteur du protéasome, un agent immunomodulateur et un anticorps monoclonal anti-CD38, et dont la maladie a progressé pendant le dernier traitement.
Prix indicatif (année) : XXX
Posologies : Le traitement est administré une fois par semaine pendant les 13 premières semaines, la dose étant progressivement augmentée pendant les trois premières semaines. Il est ensuite administré une semaine sur deux. À partir de la semaine 24, Lynozyfic peut être administré toutes les quatre semaines, en fonction de la réponse au traitement. Le traitement peut être poursuivi aussi longtemps que le patient en tire un bénéfice et que les effets indésirables ne sont pas trop graves.
Mécanisme d'action :
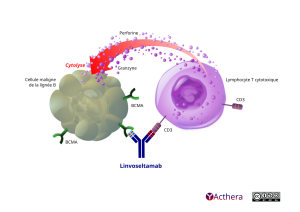
Le linvoseltamab se lie au cluster de différenciation 3 (CD3), un antigène des lymphocytes T associé au complexe du récepteur des lymphocytes T et à l’antigène de maturation des lymphocytes B (BCMA), qui est exprimé à la surface des cellules malignes de la lignée B du myélome multiple, ainsi que des lymphocytes B de stade avancé et des plasmocytes. L’engagement simultané des deux bras du linvoseltamab entraîne la formation d’une synapse entre les lymphocytes T et les cellules exprimant le BCMA. Ce processus provoque l’activation des lymphocytes T et la génération d’une réponse cytotoxique polyclonale des lymphocytes T, ce qui entraîne une lyse redirigée des cellules ciblées, dont les cellules malignes de la lignée B du myélome multiple. Cet effet se produit indépendamment de la spécificité des récepteurs des lymphocytes T ou de la dépendance aux molécules de classe I du complexe majeur d’histocompatibilité (CMH) à la surface des cellules présentant l’antigène.
LINVOSELTAMAB
À gauche dans l’illustration la cellule maligne de lignée B figurée ainsi : elle est gris verte à beige pâle. De forme ronde mais irrégulière, sa silhouette comporte de nombreuses boursouflures. Elle évoque un amas de bulles difformes fusionnées, une sorte de nuage. En son centre on discerne par transparence un noyau, lui aussi de forme irrégulière. À droite, un lymphocyte T cytotoxique se présente ainsi. De forme ronde légèrement irrégulière violet pâle. Au centre un noyau plus foncé, avec des nuances subtiles de violet et de rose. L’impression de relief du noyau est appuyée par une jeu de lumière suggérant la forme sphérique. Du centre de la cellule une légère lumière émane. Celle-ci accentue le relief. La membrane cellulaire est figurée par un léger assombrissement et un changement de couleur à la périphérie de la cellule. L’image comporte des nuances subtiles de violet. C’est une représentation simple quelque peu stylisée d'un élément scientifique complexe. Le linvolseltamab est représenté ainsi : deux chaînes lourdes du linvoveltamab (anticorps humanisé IgG4 bleu) sont différentes. La chaîne lourde de gauche (liée au BCMA) porte trois traits bleu clairs alternés de deux traits rouge. La chaîne lourde de droite (liée au CD3) porte trois traits rouge alternant avec le bleu foncé de l’anticorps.
Les deux bras de l’anticorps linvoseltamab, se lient à la fois au CD3 (cluster de différenciation) présents sur le lymphocyte T et le BCMA (antigène de maturation des lymphocyte B) sur la cellule tumorale et au CD3. Le Lymphocyte ainsi activé génère une réponse cytotoxique. L’illustration le concrétise par l’éjection depuis le coeur du lymphocyte T à droite, d’une myriade de petits grains qui se jettent sur la cellule maligne située à sa gauche. Ces grains sont annotés granzyne et perforine. L’action est soulignée par une flèche courbée partant de gauche à droite sur le cellule maligne. La cytolyse provoquera la destruction de la cellule maligne.
Le logo "Acthera" est visible en bas à droite avec à sa droite les icônes de Licence 4 Creative Commons BY NC SA.
Effets indésirables les plus fréquents : Les effets indésirables les plus couramment observés sous Lynozyfic (qui peuvent toucher plus d’une personne sur 10) sont : douleurs musculosquelettiques, syndrome de relargage cytokinique (SRC), neutropénie, toux, diarrhée, anémie, fatigue, pneumonie et infection des voies respiratoires supérieures.
(se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications :
Hypersensibilité à la substance active ou à l’un des excipients
Femmes enceintes
Allaitement
Personnes présentant une infection active
Principales références :
- Lee A. Linvoseltamab: First Approval. Drugs. 2025 Aug 29. doi: 10.1007/s40265-025-02207-8. Epub ahead of print. PMID: 40880034.
- Bumma N, Richter J, Jagannath S, Lee HC, Hoffman JE, Suvannasankha A, Zonder JA, Shah MR, Lentzsch S, Baz R, Maly JJ, Namburi S, Pianko MJ, Ye JC, Wu KL, Silbermann R, Min CK, Vekemans MC, Munder M, Byun JM, Martínez-Lopez J, Cassady K, DeVeaux M, Chokshi D, Boyapati A, Hazra A, Yancopoulos GD, Sirulnik LA, Rodriguez Lorenc K, Kroog GS, Houvras Y, Dhodapkar MV. Linvoseltamab for Treatment of Relapsed/Refractory Multiple Myeloma. J Clin Oncol. 2024 Aug 1;42(22):2702-2712. doi: 10.1200/JCO.24.01008. Epub 2024 Jun 16. Erratum in: J Clin Oncol. 2024 Nov 20;42(33):4001. doi: 10.1200/JCO-24-02169. PMID: 38879802; PMCID: PMC11272139.
- Avigan ZM, Rattu MA, Richter J. An evaluation of linvoseltamab for treatment of relapsed/refractory multiple myeloma. Expert Opin Biol Ther. 2025 Mar;25(3):221-228. doi: 10.1080/14712598.2025.2465825. Epub 2025 Feb 16. PMID: 39923122.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS (pas de données au 09/09/25)
- Base de données publique des médicaments (pas de données au 09/09/25)
- ANSM
- Meddispar (pas de données au 09/09/25)
- Vidal (pas de données au 09/09/25)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 09/09/25)
Remarque :
Création de la fiche : Ines Nouira
Dernière mise à jour : 09/09/25
Relecture par : Lorie Nguyen / Pr C. Carnoy