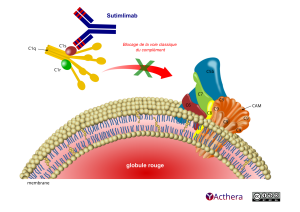
Sutimlimab (ENJAYMO®)
Autres noms : sutimlimab-jome
Structure : IgG4 kappa humanisé
Code ATC : L04AA55
Nomenclature Ge : IgG4κ G4e6
Cible: molécule du complément C1s
Mode de production : produit dans des cellules ovariennes de hamster chinois (CHO) utilisant la technologie de l’ADN recombinant
Forme galénique : Solution pour perfusion. Un flacon contient 1100 mg de sutimlimab dans 22 ml ( 50 mg/ml)
Mode d'administration : IV
Date de la première AMM : EMA novembre 2022 / FDA février 2022
Laboratoire : Genzyme / SANOFI
Indications : traitement de l’anémie hémolytique des patients adultes atteints de la maladie des agglutinines froides (MAF)
Prix indicatif (année) : XXX
Posologies : Pour les patients pesant de 39 kg à moins de 75 kg, la dose recommandée est de 6 500 mg et pour les patients pesant 75 kg ou plus, la dose recommandée est de 7 500 mg. Administrer Enjaymo par voie intraveineuse une fois par semaine pendant les deux premières semaines et toutes les deux semaines par la suite.
Mécanisme d'action :
Le sutimlimab inhibe la voie classique du complément et se lie spécifiquement au composant 1 de la protéine du complément, le souscomposant s (C1s), une protéase sérine qui clive C4. Les activités de la voie des lectines et de la voie alterne du complément ne sont pas inhibées par le sutimlimab. L’inhibition de la voie classique du complément au niveau de C1s empêche le dépôt d’opsonines du complément à la surface des globules rouges, ce qui entraîne l’inhibition de l’hémolyse chez les patients atteints de la maladie des agglutinines froides et empêche la génération des anaphylatoxines pro-inflammatoires C3a et C5a et du complexe terminal du complément en aval C5b-9 (complexe d'attaque membranaire, CAM)
Effets indésirables les plus fréquents : (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Dhillon S. Sutimlimab: First Approval. Drugs. 2022 May;82(7):817-823. doi: 10.1007/s40265-022-01711-5. PMID: 35412113.
- Röth A, Berentsen S, Barcellini W, D'Sa S, Jilma B, Michel M, Weitz IC, Yamaguchi M, Nishimura JI, Vos JMI, Storek M, Wong N, Patel P, Jiang X, Vagge DS, Wardęcki M, Shafer F, Lee M, Broome CM. Sutimlimab in patients with cold agglutinin disease: results of the randomized placebo-controlled phase 3 CADENZA trial. Blood. 2022 Sep 1;140(9):980-991. doi: 10.1182/blood.2021014955. PMID: 35687757; PMCID: PMC9437710.
- Berentsen S, Barcellini W, D'Sa S, Jilma B. Sutimlimab for treatment of cold agglutinin disease: why, how and for whom? Immunotherapy. 2022 Oct;14(15):1191-1204. doi: 10.2217/imt-2022-0085. Epub 2022 Aug 10. PMID: 35946351.
- Roth A, Barcellini W, D'Sa S, Miyakawa Y, Broome CM, Michel M, Kuter DJ, Jilma B, Tvedt THA, Weitz IC, Patel P, Jiang X, Reuter C, Su J, Shafer F, Lee M, Berentsen S. Complement C1s inhibition with sutimlimab results in durable response in cold agglutinin disease: CARDINAL study 1-year interim follow-up results. Haematologica. 2022 Jul 1;107(7):1698-1702. doi: 10.3324/haematol.2021.279812. PMID: 35172561; PMCID: PMC9244812.
- Röth A, Barcellini W, D'Sa S, Miyakawa Y, Broome CM, Michel M, Kuter DJ, Jilma B, Tvedt THA, Fruebis J, Jiang X, Lin S, Reuter C, Morales-Arias J, Hobbs W, Berentsen S. Sutimlimab in Cold Agglutinin Disease. N Engl J Med. 2021 Apr 8;384(14):1323-1334. doi: 10.1056/NEJMoa2027760. PMID: 33826820.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS (pas de données au 26 janvier 2023)
- Base de données publique des médicaments (pas de données au 26 janvier 2023)
- ANSM (pas de données au 26 janvier 2023)
- Meddispar (pas de données au 26 janvier 2023)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 26 janvier 2023)
Remarque :
Dernière mise à jour : 26/01/23
Relecture par : Pr C. Carnoy