Nivolumab (OPDIVO®)
AcM humain, IgG4
Code ATC : L01XC17
Nomenclature Ge : IgG4κ G4e1
Mode de production : Ce médicament est produit sur des cellules ovariennes de hamster chinois, par la technologie de l'ADN recombinant.
Forme galénique : Solution à diluer pour perfusion de 10 mg/mL (en flacon de 4, 10, 12 ou 24 mL).
Mode d'administration : IV
Conservation :
Non diluée ou diluée dans une solution de NaCl 0,9%
30 jours au réfrigérateur entre 2 et 8°C
24h à t° ambiante
Diluée dans une solution de glucose 5%
7 jours au réfrigérateur entre 2 et 8°C
8h à t° ambiante
Date de la première AMM : EMA 2015 / FDA 2015
Laboratoires : Bristol-Myers Squibb
Indications :
- Mélanome : en monothérapie ou en association à l'ipilimumab dans le traitement d'un mélanome avancé (non résécable ou métastatique). Il peut également être utilisé en monothérapie dans le traitement adjuvant des patients adultes atteints d’un mélanome avec atteinte des ganglions lymphatiques ou une maladie métastatique, et ayant subi une résection complète
- Cancer bronchique non à petites cellules (CBNPC) :
en monothérapie dans le traitement d'un cancer bronchique non à petites cellules localement avancé ou métastatique après une chimiothérapie antérieure OU
en association à l’ipilimumab et à 2 cycles de chimiothérapie à base de sels de platine, en première ligne, dans le traitement des patients adultes atteints d’un cancer bronchique non à petites cellules métastatique dont les tumeurs ne présentent pas la mutation sensibilisante de l’EGFR, ni la translocation ALK.
- Mésothélium pleural malin : En association à l’ipilimumab, en première ligne, dans le traitement des patients adultes atteints d’un mésothéliome pleural malin non résécable.
- Carcinome à cellules rénales (CCR):
En monothérapie dans le traitement d'un carcinome à cellules rénales avancé après un traitement antérieur.
En association à l’ipilimumab, en première ligne, dans le traitement des patients adultes atteints d’un carcinome à cellules rénales avancé de pronostic intermédiaire/défavorable
En association au cabozantinib, en première ligne, dans le traitement des patients adultes atteints d’un carcinome à cellules rénales avancé.
- Lymphome de Hodgkin classique (LHc) : en monothérapie dans le traitement d'un lymphome de Hodgkin classique en rechute ou réfractaire après une greffe de cellules souches autologue (GCSA) et un traitement par brentuximab vedotin.
- Cancer épidermoïde de la tête et du cou (SCCHN) : en monothérapie dans le traitement d'un cancer épidermoïde de la tête et du cou en progression pendant ou après une chimiothérapie à base de sels de platine.
- Carcinome urothélial : en monothérapie dans le traitement d'un carcinome urothélial localement avancé non résécable ou métastatique après échec d'une chimiothérapie antérieure à base de sels de platine. Peut également être utilisé en monothérapie dans le traitement adjuvant des patients adultes atteints de carcinome urothélial infiltrant le muscle (CUIM) à haut risque de récidive après exérèse complète, dont les cellules tumorales expriment PD-L1 au seuil ≥ 1%.
- Cancer colorectal : Indiqué en association à l’ipilimumab, dans le traitement des patients adultes atteints d’un cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l’ADN ou une instabilité microsatellitaire élevée après une association antérieure de chimiothérapie à base de fluoropyrimidine.
- Carcinome épidermoïde de l'oesophage :
en association à l’ipilimumab, en première ligne si les cellules tumorales expriment PD-L1 au seuil ≥ 1%
en association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne, si les cellules tumorales expriment PD-L1 au seuil ≥ 1%.
en monothérapie, en 2e ligne, après une chimiothérapie combinée antérieure à base de fluoropyrimidine et de sels de platine.
en traitement adjuvant des patients adultes atteints d’un cancer de l’œsophage ou de la jonction œso-gastrique et qui présentent une maladie résiduelle après une radiochimiothérapie néoadjuvante antérieure.
en association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne, dans le traitement des patients adultes atteints d’un adénocarcinome gastrique, de la jonction œso-gastrique ou de l’œsophage avancé ou métastatique, HER-2 négatif, dont les tumeurs expriment PD-L1 avec un score combiné positif (Combined Positive Score : CPS) ≥ 5
Usage : Médicament réservé à l'usage hospitalier. Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang. Non disponible à l'officine en ville.
Posologies : Soit 240 mg toutes les 2 semaines, soit 480 mg toutes les 4 semaines. Si le médicament est en association avec l'ipilimumab, on est plutôt sur 1mg/kg de nivolumab associé à 3mg/kg d'ipilimumab toutes les 3 semaines sur 4 cycles d'administration (en perfusion de 30 min).
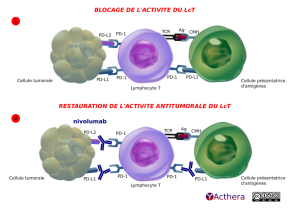
Mécanisme d'action :
Nivolumab est dirigé contre une molécule du checkpoint immunologique, PD-1, qui est exprimée au cours des stimulations antigéniques sur les lymphocytes T CD4+ et CD8+ épuisés. Nivolumab empêche l'interaction de PD-1 avec ses deux ligands connus PDL-1 et PDL-2 présents sur les cellules tumorales, ainsi que sur les cellules dendritiques (schéma 2). L'interaction PD-1 / PDL-1 envoie des signaux répresseurs au lymphocyte T qui devient incapable de contrôler l'expansion des cellules tumorales (schéma 1). Nivolumab est dépourvu de capacité cytotoxique (ADCC) afin de ne pas dépléter les cellules exprimant PD-1 telles que les cellules NK, les LcB, les monocytes. Nivolumab possède le même mécanisme d'action que le Pembrolizumab.
Effets indésirables les plus fréquents: infections, diminutions d'une ou plusieurs lignées sanguines, fatigue, rash, prurits, diarrhées et nausées, diminution de l'appétit.
Contre-indications : hypersensibilité au médicament.
Utilisation chez la femme enceinte : Aucune donnée sur l'utilisation de nivolumab n'est disponible chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité embryofœtale (liée à l'IgG4). Une méthode efficace de contraception doit être utilisée pendant toute la durée du traitement et poursuivie pendant 5 mois après la dernière perfusion de nivolumab.
Principales références :
- Postow et al., 2015 ; Bayless and Schneider, 2015
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Opdivo
- IMGT/DB
- Vidal : article sur la prise en charge du mélanome avancé (2015)
Remarque :
Dernière mise à jour : Mars 2023
Par : Mathilde GLAZIOU