Gemtuzumab ozogamicin (MYLOTARG®)
Structure : IgG4 kappa humanizé couplé à l'ozogamicine, dérivé hémisynthétique de la calichéamicine fortement cytotoxique
Code ATC : L01XC05
Nomenclature Ge : IgG4κ G4e1
Cible: CD33
Mode de production : Produit par culture de cellule de mammifère dans les cellules NS0
Forme galénique : Flacon de poudre pour solution à diluer pour perfusion contenant 5 mg de gemtuzumab ozogamicine. Après reconstitution , la solution concentrée contient 1 mg/ml de gemtuzumab ozogamicine
Mode d'administration : IV
Date de la première AMM : EMA avril 2018 / FDA 2000 (retrait en 2010) puis 2017
Laboratoires et lien vers xxx: Pfizer Europe MA EEIG
Indications : MYLOTARG est indiqué en association avec la daunorubicine (DNR) et la cytarabine (AraC) dans le traitement de patients âgés de 15 ans et plus atteints de leucémie aiguë myéloïde (LAM) d’expression positive du CD33 de novo, à l’exception de la leucémie aiguë promyélocytaire (LAP), naïfs de traitement
Prix indicatif (année) : XXX
Usage : xxx
Posologies :
En induction, la dose recommandée de MYLOTARG est de 3 mg/m2/dose (jusqu’à maximum un flacon de 5 mg) administrée en perfusion de 2 heures aux Jours 1, 4 et 7 en association avec de la DNR 60 mg/m2/jour administrée en perfusion de 30 minutes du Jour 1 au Jour 3, et de l’AraC 200 mg/m2/jour administrée en perfusion continue du Jour 1 au Jour 7.
En consolidation , pour les patients présentant une rémission complète (RC) après induction, définie comme la présence de moins de 5 % de cellules blastiques dans une moelle normocellulaire et une numération absolue des neutrophiles (NAN) supérieure à 1,0 × 109 cellules/l avec une numération plaquettaire dans le sang périphérique supérieure ou égale à 100 × 109/l en l’absence de transfusion, jusqu’à 2 cycles de consolidation de DNR par voie intraveineuse (60 mg/m2 pendant 1 jour [premier cycle] ou 2 jours [deuxième cycle]) en association avec de l’AraC par voie intraveineuse (1 g/m2 toutes les 12 heures, en perfusion de 2 heures du Jour 1 au Jour 4) avec MYLOTARG par voie intraveineuse (3 mg/m2/dose en perfusion de 2 heures jusqu’à une dose maximale d’un flacon de 5 mg le Jour 1) sont recommandés.
Mécanisme d'action :
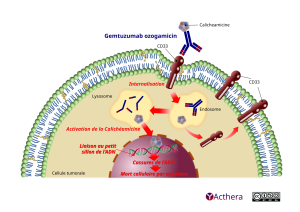
Le gemtuzumab ozogamicine est un conjugué anticorps-médicament (CAM) qui se lie spécifiquement à l’antigène CD33, protéine d’adhésion dépendante de l’acide sialique, présente sur la surface des blastes leucémiques myéloïdes et sur les cellules immatures normales de la lignée myélomonocytaire, mais pas sur les cellules souches hématopoïétiques normales. La N-acétyl-gamma-calichéamicine, est un produit naturel semi-synthétique cytotoxique. La N-acétyl-gamma-calichéamicine est liée par covalence à l’anticorps via un agent de liaison AcBut (acide 4-(4-acétylphénoxy)butanoïque). Les données suggèrent que l’activité anticancéreuse du gemtuzumab ozogamicine est due à la liaison du CAM aux cellules cancéreuses exprimant le CD33, suivie par l’internalisation du complexe CAM-CD33, et par la libération intracellulaire du N-acétyl-gamma-calichéamicine diméthylhydrazide via le clivage hydrolytique de l’agent de liaison. L’activation du N-acétyl-gamma-calichéamicine diméthylhydrazide induit des ruptures des doubles brins d’ADN, induisant par la suite un arrêt du cycle cellulaire et une mort cellulaire apoptotique.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquents (> 30 %) survenus au cours de l’étude en polythérapie ont été les suivants : hémorragie et infection. Au cours des études en monothérapie, les effets indésirables les plus fréquents (> 30 %) ont inclus : fièvre, nausées, infection, frissons, hémorragie, vomissements, thrombopénie, fatigue, céphalées, stomatite, diarrhée, douleurs abdominales et neutropénie. Dans l’étude B1761031 en monothérapie, les effets indésirables les plus fréquents (> 30 %) ont inclus l’infection (50,0 %), la neutropénie fébrile (40,0 %) et l’hémorragie (32,0 %). (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Maakaron JE, Rogosheske J, Long M, Bachanova V, Mims AS. CD33-Targeted Therapies: Beating the Disease or Beaten to Death? J Clin Pharmacol. 2021 Jan;61(1):7-17. doi: 10.1002/jcph.1730. Epub 2020 Sep 1. PMID: 32875599.
- Selby C, Yacko LR, Glode AE. Gemtuzumab Ozogamicin: Back Again. J Adv Pract Oncol. 2019 Jan-Feb;10(1):68-82. Epub 2019 Jan 1. PMID: 31308990; PMCID: PMC6605703.
- Hills RK, Castaigne S, Appelbaum FR, Delaunay J, Petersdorf S, Othus M, Estey EH, Dombret H, Chevret S, Ifrah N, Cahn JY, Récher C, Chilton L, Moorman AV, Burnett AK. Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol. 2014 Aug;15(9):986-96. doi: 10.1016/S1470-2045(14)70281-5. Epub 2014 Jul 6. PMID: 25008258; PMCID: PMC4137593.
- Döhner H, Weber D, Krzykalla J, Fiedler W, Kühn MWM, Schroeder T, Mayer K, Lübbert M, Wattad M, Götze K, Fransecky L, Koller E, Wulf G, Schleicher J, Ringhoffer M, Greil R, Hertenstein B, Krauter J, Martens UM, Nachbaur D, Samra MA, Machherndl-Spandl S, Basara N, Leis C, Schrade A, Kapp-Schwoerer S, Cocciardi S, Bullinger L, Thol F, Heuser M, Paschka P, Gaidzik VI, Saadati M, Benner A, Schlenk RF, Döhner K, Ganser A; German–Austrian AML Study Group. Intensive chemotherapy with or without gemtuzumab ozogamicin in patients with NPM1-mutated acute myeloid leukaemia (AMLSG 09-09): a randomised, open-label, multicentre, phase 3 trial. Lancet Haematol. 2023 Jul;10(7):e495-e509. doi: 10.1016/S2352-3026(23)00089-3. Epub 2023 May 12. PMID: 37187198.
- Pollard JA, Guest E, Alonzo TA, Gerbing RB, Loken MR, Brodersen LE, Kolb EA, Aplenc R, Meshinchi S, Raimondi SC, Hirsch B, Gamis AS. Gemtuzumab Ozogamicin Improves Event-Free Survival and Reduces Relapse in Pediatric KMT2A-Rearranged AML: Results From the Phase III Children's Oncology Group Trial AAML0531. J Clin Oncol. 2021 Oct 1;39(28):3149-3160. doi: 10.1200/JCO.20.03048. Epub 2021 May 28. PMID: 34048275; PMCID: PMC8478392.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar (pas de données au 7 juillet 2023)
- Centre de référence sur les agents tératogènes (CRAT)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 7 juillet 2023
Relecture par :