Teclistamab (TECVAYLI®)
Autres noms : teclistamab-cqyv
Structure : Anticorps bispécifique humanisé de type immunoglobuline G4-proline, alanine, alanine (IgG4-PAA)
Code ATC : L01FX
Nomenclature Ge : IgG4λ G4e7
Cible: Antigène de maturation des lymphocytes B (BCMA) et la sous-unité epsilon du CD3
Mode de production : produit dans une lignée cellulaire de mammifère (ovaire de hamster chinois [CHO]) à l’aide de la technologie de l’ADN recombinant
Forme galénique : Solution injectable à 10 mg/mL (flacon de 3 mL contenant 30 mg de teclistamab) ou à 90 mg/mL (flacon de 1,7 mL contenant 153 mg de teclistamab)
Mode d'administration : SC
Date de la première AMM : EMA aout 2022 / FDA octobre 2022
Laboratoire : Janssen-Cilag International N.V. Lien vers page TECVAYLI
Indications : indiqué en monothérapie, pour le traitement des patients adultes atteints d’un myélome multiple en rechute et réfractaire, ayant reçu au moins trois traitements antérieurs, incluant un agent immunomodulateur, un inhibiteur du protéasome et un anticorps anti-CD38 et dont la maladie a progressé pendant le dernier traitement
Prix indicatif (année) : XXX
Posologies : Une prémédication (corticoïde, antihistaminique, antipyrétiques) doit être administrée avant chaque dose de TECVAYLI durant le schéma d'escalade de dose Les doses recommandées de teclistamab sont de 1,5 mg/kg par injection sous-cutanée (SC) une fois par semaine, précédées par une escalade de doses de 0,06 mg/kg et 0,3 mg/kg. Le traitement par TECVAYLI doit être initié selon le schéma d'escalade de dose afin de réduire l’incidence et la sévérité du syndrome de relargage des cytokines. En raison du risque de syndrome de relargage des cytokines, il convient de demander aux patients de rester à proximité d'un établissement de santé et de faire l'objet d'une surveillance quotidienne des signes et symptômes de SRC pendant 48 heures après l'administration de chaque dose du schéma d'escalade de dose de TECVAYLI
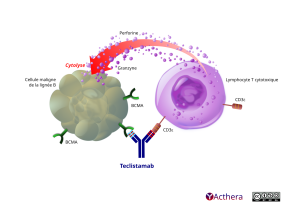
Mécanisme d'action :
Le teclistamab est un anticorps bispécifique de type IgG4-PAA complet, qui cible le récepteur CD3 exprimé à la surface des lymphocytes T et l’antigène de maturation des lymphocytes B (BCMA), qui est exprimé à la surface des cellules malignes de la lignée B du myélome multiple, ainsi que des lymphocytes B à un stade de différenciation avancé et des plasmocytes. Avec ses deux sites de liaison, le teclistamab est capable d’attirer les lymphocytes T CD3+ à proximité des cellules BCMA+, entraînant l’activation des lymphocytes T, puis la lyse et la mort des cellules BCMA+ médiée par la sécrétion de perforine et de diverses granzymes stockées dans les vésicules sécrétoires des lymphocytes T cytotoxiques. Cet effet se produit sans tenir compte de la spécificité des récepteurs des lymphocytes T ou de la présence de molécules du complexe majeur d’histocompatibilité (CMH) de classe 1 à la surface des cellules présentant l’antigène
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquents de tous grades confondus :une hypogammaglobulinémie (75 %), un syndrome de relargage des cytokines (72 %), une neutropénie (71 %), une anémie (55 %), des douleurs musculosquelettiques (52 %), une fatigue (41 %), une thrombopénie (40 %), une réaction au site d’injection (38 %), une infection des voies aériennes supérieures (37 %), une lymphopénie (35 %), une diarrhée (28 %), une pneumonie (28 %), des nausées (27 %), une fièvre (27 %), des céphalées (24 %), une toux (24 %), une constipation (21 %) et une douleur (21 %) (se référer au RCP pour avoir la liste complète des effets indésirables)
Des effets indésirables graves ont été signalés chez 65 % des patients ayant reçu TECVAYLI notamment : une pneumonie (16 %), une COVID-19 (15 %), un syndrome de relargage des cytokines (8 %), un sepsis (7 %), une fièvre (5 %), des douleurs musculosquelettiques (5 %), une insuffisance rénale aiguë (4,8 %), une diarrhée (3,0 %), une cellulite (2,4 %), une hypoxie (2,4 %), une neutropénie fébrile (2,4 %) et une encéphalopathie (2,4 %)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Kang C. Teclistamab: First Approval. Drugs. 2022 Nov;82(16):1613-1619. doi: 10.1007/s40265-022-01793-1. PMID: 36352205; PMCID: PMC9646474.
- Moreau P, Garfall AL, van de Donk NWCJ, Nahi H, San-Miguel JF, Oriol A, Nooka AK, Martin T, Rosinol L, Chari A, Karlin L, Benboubker L, Mateos MV, Bahlis N, Popat R, Besemer B, Martínez-López J, Sidana S, Delforge M, Pei L, Trancucci D, Verona R, Girgis S, Lin SXW, Olyslager Y, Jaffe M, Uhlar C, Stephenson T, Van Rampelbergh R, Banerjee A, Goldberg JD, Kobos R, Krishnan A, Usmani SZ. Teclistamab in Relapsed or Refractory Multiple Myeloma. N Engl J Med. 2022 Aug 11;387(6):495-505. doi: 10.1056/NEJMoa2203478. Epub 2022 Jun 5. PMID: 35661166.
- Usmani SZ, Garfall AL, van de Donk NWCJ, Nahi H, San-Miguel JF, Oriol A, Rosinol L, Chari A, Bhutani M, Karlin L, Benboubker L, Pei L, Verona R, Girgis S, Stephenson T, Elsayed Y, Infante J, Goldberg JD, Banerjee A, Mateos MV, Krishnan A. Teclistamab, a B-cell maturation antigen × CD3 bispecific antibody, in patients with relapsed or refractory multiple myeloma (MajesTEC-1): a multicentre, open-label, single-arm, phase 1 study. Lancet. 2021 Aug 21;398(10301):665-674. doi: 10.1016/S0140-6736(21)01338-6. Epub 2021 Aug 10. PMID: 34388396.
- Pillarisetti K, Powers G, Luistro L, Babich A, Baldwin E, Li Y, Zhang X, Mendonça M, Majewski N, Nanjunda R, Chin D, Packman K, Elsayed Y, Attar R, Gaudet F. Teclistamab is an active T cell-redirecting bispecific antibody against B-cell maturation antigen for multiple myeloma. Blood Adv. 2020 Sep 22;4(18):4538-4549. doi: 10.1182/bloodadvances.2020002393. PMID: 32956453; PMCID: PMC7509877.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments : TECVAYLI 10 mg/mL ; TECVAYLI 90 mg/mL
- ANSM
- Meddispar (pas de données au 18 avril 2023)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 18 avril 2023)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 17 mai 2023
Relecture par :