Panitumumab (VECTIBIX®)
AcM humain, IgG2k
Code ATC : L01XC08
Nomenclature Ge : IgG1κ G2e0
Cible: EGFR, ERBB-1
Mode d'administration : IV
Date de la première AMM : EMA 2007 / FDA 2006
Laboratoire : Abgenix
Indications : traitement des patients atteints d'un cancer colorectal métastatique (CCRm) avec un statut RAS non muté (type sauvage)
- en première ligne en association avec un protocole FOLFOX ou FOLFIRI.
- en seconde ligne en association avec un protocole FOLFIRI pour les patients qui ont reçu en première ligne un protocole de chimiothérapie à base de fluoropyrimidine (excluant l'irinotécan).
- en monothérapie après échec des protocoles de chimiothérapie à base de fluoropyrimidine, oxaliplatine et irinotécan.
Prix indicatif: 365,500 € pour 100 mg de panitumumab (2013)
Usage : réservé à l'usage hospitalier
Posologies : 6 mg/kg de poids corporel 1 fois toutes les 2 semaines
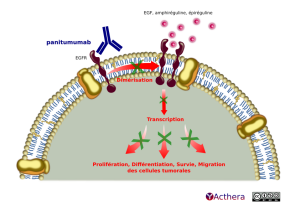
Mécanisme d'action :
Le panitumumab se fixe au domaine de liaison du ligand de l'EGFR et empêche ainsi la dimérisation des récepteurs et leur autophosphorylation. La fixation du panitumumab à l'EGFR a pour effet l'internalisation du récepteur, l'inhibition du développement cellulaire, l'induction d'une apoptose et la diminution de la production d'IL-8 qui potentialise la migration des cellules tumorales.
Effets indésirables les plus fréquents: paronychie, anémie, insomnie
Contre-indications : hypersensibilité au médicament, patients présentant une pneumopathie interstitielle ou une fibrose pulmonaire
Principales références :
- Douillard et al., 2010
- Avis de la HAS sur Vectibix
- Lien vers Human medicine European public assessment report (EPAR)