Concizumab (ALHEMO®)
Structure : AcM humanisé de type IgG4 kappa
Code ATC : B02BX10
Nomenclature Ge : xxx
Cible: Tissue factor pathway inhibitor, TFPI
Mode de production : Produit par la technologie de l’ADN recombinant dans des cellules d’ovaires de hamster de Chine (CHO)
Forme galénique : solution injectable en stylo prérempli aux concentration de 15 mg/1,5 ml, 60 mg/1,5 ml, 150 mg/1,5 ml ou 300 mg/3 ml
Mode d'administration : Sous-cutanée
Date de la première AMM : FDA 2024 / EMA décembre 2024
Laboratoire : Novo Nordisk
Indications :
Indiqué en prophylaxie pour la prévention des épisodes hémorragiques chez les patients atteints de :
• Hémophilie A (déficit congénital en facteur VIII) avec inhibiteurs du FVIII et âgés de 12 ans ou plus.
• Hémophilie B (déficit congénital en facteur IX) avec inhibiteurs du FIX et âgés de 12 ans ou plus.
Prix indicatif (année) : XXX
Usage : Le médicament n’est délivré que sur ordonnance. Le traitement doit être instauré sous la surveillance d’un médecin expérimenté dans le traitement de l’hémophilie ou des troubles de l’hémostase (troubles hémorragiques).
Posologies :
Le schéma posologique recommandé est
• Jour 1 : une dose de charge de 1 mg/kg, en une seule fois.
• Jour 2 et jusqu’à l’établissement de la dose d’entretien individuelle (voir ci-dessous) : administration une fois par jour de 0,20 mg/kg.
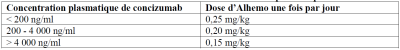
• 4 semaines après l’initiation du traitement : mesure de la concentration plasmatique de concizumab avant l’administration de la dose programmée suivante. La mesure doit être effectuée à l'aide d'un test diagnostique in vitro validé.
• Lorsque le résultat de la concentration plasmatique de concizumab est disponible : la dose d’entretien individuelle est définie une fois en fonction de la concentration plasmatique de concizumab comme indiqué ci-dessous.
Dose d’entretien individuelle basée sur la concentration plasmatique de concizumab :
Mécanisme d'action :
Concizumab est un anticorps anti-inhibiteur de la voie du facteur tissulaire (tissue factor pathway inhibitor, TFPI). Le TFPI est un inhibiteur du facteur Xa (FXa). La liaison du concizumab au TFPI empêche l’inhibition du FXa par le TFPI. L’activité accrue du FXa prolonge la phase d’initiation de la coagulation et permet une génération suffisante de thrombine pour une hémostase efficace. Concizumab agit indépendamment du FVIII et du FIX.
Effets indésirables les plus fréquents : Les effets indésirables les plus couramment observés sous Alhemo (qui peuvent toucher plus d’une personne sur 10) sont notamment les réactions au site d’injection. Les plus fréquents sont les événements thromboemboliques (0,9 %) et l’hypersensibilité (0,3 %) (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Shapiro AD, Angchaisuksiri P, Astermark J, Benson G, Castaman G, Chowdary P, Eichler H, Jiménez-Yuste V, Kavakli K, Matsushita T, Poulsen LH, Wheeler AP, Young G, Zupancic-Salek S, Oldenburg J. Subcutaneous concizumab prophylaxis in hemophilia A and hemophilia A/B with inhibitors: phase 2 trial results. Blood. 2019 Nov 28;134(22):1973-1982. doi: 10.1182/blood.2019001542. PMID: 31444162; PMCID: PMC6895373.
- Matsushita T, Shapiro A, Abraham A, Angchaisuksiri P, Castaman G, Cepo K, d'Oiron R, Frei-Jones M, Goh AS, Haaning J, Hald Jacobsen S, Mahlangu J, Mathias M, Nogami K, Skovgaard Rasmussen J, Stasyshyn O, Tran H, Vilchevska K, Villarreal Martinez L, Windyga J, You CW, Zozulya N, Zulfikar B, Jiménez-Yuste V; explorer7 Investigators. Phase 3 Trial of Concizumab in Hemophilia with Inhibitors. N Engl J Med. 2023 Aug 31;389(9):783-794. doi: 10.1056/NEJMoa2216455. PMID: 37646676.
- Chowdary P, Angchaisuksiri P, Apte S, Astermark J, Benson G, Chan AKC, Jiménez Yuste V, Matsushita T, Høgh Nielsen AR, Sathar J, Sutton C, Šaulytė Trakymienė S, Tran H, Villarreal Martinez L, Wheeler AP, Windyga J, Young G, Thaung Zaw JJ, Eichler H. Concizumab prophylaxis in people with haemophilia A or haemophilia B without inhibitors (explorer8): a prospective, multicentre, open-label, randomised, phase 3a trial. Lancet Haematol. 2024 Dec;11(12):e891-e904. doi: 10.1016/S2352-3026(24)00307-7. Epub 2024 Nov 6. Erratum in: Lancet Haematol. 2024 Dec;11(12):e886. doi: 10.1016/S2352-3026(24)00353-3. PMID: 39521008.
- Siddiqui E, Khalid M, Khan MS, Farhan K, Khan MM, Waafira A. Evaluating the Safety and Efficacy of Concizumab in Hemophilia A/B Patients: A Systematic Review. Clin Appl Thromb Hemost. 2025 Jan-Dec;31:10760296251342968. doi: 10.1177/10760296251342968. Epub 2025 May 14. PMID: 40368339; PMCID: PMC12078972.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas de données au 27 juin 2025)
- ANSM
- Meddispar (pas de données au 27 juin 2025)
- Vidal
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 27 juin 2025)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 15/06/25
Relecture par : Lorie Nguyen