Talquetamab (TALVEY®)
Autres noms : talquetamab-tgvs
Structure : AcM bispécifique humanisé / chimérique de type IgG4 kappa (IgG4-proline, alanine, alanine (IgG4-PAA))
Code ATC : L01FX29
Nomenclature Ge : xxx
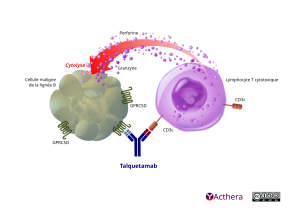
Cible: CD3 epsilon et GPRC5D (G protein-coupled receptor class C group 5 member D)
Mode de production : Produit dans les cellules ovariennes de hamster chinois par la technologie de l’ADN recombinant
Forme galénique : Flacon de 1,5 mL contenant 3 mg de talquetamab (TALVEY 2 mg/mL) et flacon de 1 mL contient 40 mg de talquetamab (TALVEY 40 mg/mL)
Mode d'administration : SC
Date de la première AMM : EMA aout 2023 / FDA aout 2023
Laboratoire : Janssen-Cilag
Indications : indiqué en monothérapie pour le traitement des patients adultes atteints d’un myélome multiple en rechute et réfractaire, ayant reçu au moins trois traitements antérieurs, incluant un agent immunomodulateur, un inhibiteur du protéasome et un anticorps anti-CD38 et dont la maladie a progressé pendant le dernier traitement
Prix indicatif (année) : XXX
Posologies : talvey poso.png[1]
Mécanisme d'action :
Le talquetamab favorise une cytotoxicité médiée par les lymphocytes T en redirigeant les lymphocytes T exprimant CD3 vers les cellules exprimant GPRC5D. Cela conduit à l’activation des lymphocytes T et induit ainsi une lyse des cellules exprimant GPRC5D, grâce à la sécrétion de perforine et de diverses granzymes stockées dans les vésicules sécrétoires des lymphocytes T cytotoxiques. Sur la base de l’expression de GPRC5D sur les cellules plasmatiques avec une expression minimale ou nulle détectée sur les lymphocytes B et les précurseurs des lymphocytes B, le talquetamab cible particulièrement les cellules du myélome multiple
Effets indésirables les plus fréquents :
le syndrome de relargage cytokinique (SRC) (77 %), la dysgueusie (72 %), l’hypogammaglobulinémie (67 %), les troubles unguéaux (56 %), les douleurs musculosquelettiques (48 %), l’anémie (47 %), les troubles cutanés (43 %), la fatigue (43 %), la perte de poids (40 %), le rash (39 %), la sécheresse buccale (36 %), la neutropénie (35 %) la fièvre (33 %), la xérose (32 %), la thrombopénie (30 %), l’infection des voies aériennes supérieures (29 %) ; la lymphopénie (27 %), la dysphagie (24 %), la diarrhée (25 %), le prurit (23 %), la toux (23 %), des douleurs (22 %), un appétit diminué (22 %) et des céphalées (20 %).
Les effets indésirables graves rapportés chez les patients comprenaient : SRC (13 %), fièvre (5 %), ICANS (3,8 %), sepsis (3,8 %), COVID-19 (3,2 %), infection bactérienne (2,4 %), pneumonie (2,4 %), infection virale (2,4 %), neutropénie (2,1 %) et douleurs (2,1 %). (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Keam SJ. Talquetamab: First Approval. Drugs. 2023 Oct;83(15):1439-1445. doi: 10.1007/s40265-023-01945-x. PMID: 37792138.
- Chari A, Minnema MC, Berdeja JG, Oriol A, van de Donk NWCJ, Rodríguez-Otero P, Askari E, Mateos MV, Costa LJ, Caers J, Verona R, Girgis S, Yang S, Goldsmith RB, Yao X, Pillarisetti K, Hilder BW, Russell J, Goldberg JD, Krishnan A. Talquetamab, a T-Cell-Redirecting GPRC5D Bispecific Antibody for Multiple Myeloma. N Engl J Med. 2022 Dec 15;387(24):2232-2244. doi: 10.1056/NEJMoa2204591. Epub 2022 Dec 10. PMID: 36507686.
- Firestone R, Lesokhin AM, Usmani SZ. An Embarrassment of Riches: Three FDA-Approved Bispecific Antibodies for Relapsed Refractory Multiple Myeloma. Blood Cancer Discov. 2023 Nov 1;4(6):433-436. doi: 10.1158/2643-3230.BCD-23-0176. PMID: 37824758; PMCID: PMC10618718.
- Morè S, Corvatta L, Manieri VM, Morsia E, Poloni A, Offidani M. Novel Immunotherapies and Combinations: The Future Landscape of Multiple Myeloma Treatment. Pharmaceuticals (Basel). 2023 Nov 19;16(11):1628. doi: 10.3390/ph16111628. PMID: 38004493; PMCID: PMC10675193.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas de données au 2 octobre 2025)
- ANSM (pas de données au 2 octobre 2025)
- Meddispar (pas de données au 2 octobre 2025)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 2 octobre 2025)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 2 octobre 2025
Relecture par :