Toripalimab (LOQTORZI®)
Autre nom : toripalimab-tpzi
Structure : AcM humanisé de type IgG4 kappa
Code ATC : L01FF13
Nomenclature Ge : xxx
Cible: PD-1
Mode de production : Le toripalimab est produit dans des cellules ovariennes de hamster chinois par la technique de l’ADN recombinant.
Forme galénique : 1 flacon de 6 ml (40 mg/ml). Solution à diluer pour perfusion.
Mode d'administration : IV
Date de la première AMM : EMA septembre 2024 / FDA 2023
Laboratoires : TMC Pharma (EU)
Indications :
Toripalimab est indiqué chez l’adulte pour traiter le :
en association au cisplatine et à la gemcitabine, dans le traitement de première ligne des patients adultes atteints d’un carcinome du nasopharynx métastatique ou récidivant, non éligible à un traitement par chirurgie ou par radiothérapie
Carcinome épidermoïde de l'oesophage (CEO) :
en association au cisplatine et au paclitaxel, dans le traitement de première ligne des patients adultes atteints d’un carcinome épidermoïde de l’œsophage avancé non résécable, récidivant ou métastatique
Prix indicatif (année) : XXX
Usage : Le traitement doit être instauré et surveillé par un médecin expérimenté dans le traitement du cancer.
Posologies : Le schéma posologique recommandé de LOQTORZI est 240 mg administrés toutes les 3 semaines par perfusion intraveineuse en 60 minutes pour la première perfusion. Si aucune réaction significative liée à la perfusion n’est survenue au cours de la première perfusion, les perfusions suivantes pourront être administrées en 30 minutes. Le traitement doit être poursuivi jusqu’à la progression de la maladie, jusqu’à la survenue d’une toxicité inacceptable ou jusqu’à une durée maximale de 24 mois.
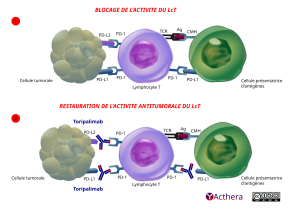
Mécanisme d'action :
Le toripalimab se lie au récepteur PD-1 et bloque son interaction avec PD-L1 et PD-L2, libérant ainsi l’inhibition médiée par la voie PD-1 de la réponse immunitaire, notamment la réponse immunitaire anti-tumorale. La liaison des ligands de PD-1, PD-L1 et PD-L2 au récepteur PD-1 qui se trouve sur les lymphocytes T inhibe la prolifération des lymphocytes T, la production de cytokines et l’activité cytotoxique. Les cellules cancéreuses peuvent produire des protéines (PD-L1 et PD-L2) qui se fixent sur ce récepteur et neutralisent l’activité des lymphocytes T, empêchant ainsi l'action antitumorale.
Effets indésirables les plus fréquents : La sécurité du toripalimab en association à une chimiothérapie à base de platine a été évaluée chez 403 patients atteints d’un carcinome du nasopharynx (CNP) ou d’un carcinome épidermoïde de l’œsophage (CEO) recevant 240 mg de toripalimab toutes les 3 semaines dans les études JUPITER-02 ou JUPITER-06. La durée médiane de traitement chez ces patients était de 6,5 mois (intervalle de 1 jour à 2,1 ans). Dans cette population de patients, les effets indésirables les plus fréquents étaient l’anémie (44,9 %), la leucopénie (41,7 %), la neutropénie (39,0 %), la thrombopénie (30,3 %), la nausée (29,8 %), le vomissement (27,3 %), l’appétit diminué (23,8 %), l’éruption cutanée (23,8 %), la fatigue (23,6 %), le bilan hépatique anormal (22,3 %), l’hypothyroïdie (18,4 %), la constipation (16,6 %), la neuropathie (15,1 %), la colite (14,1 %), la fièvre (13,6 %), la toux (11,4 %), le prurit (11,4 %), la diminution de la clairance de la créatinine (11,2 %), et l’hyponatrémie (10,2 %). Les incidences des effets indésirables de grades 3 à 5 chez les patients atteints de CNP étaient de 81,5 % pour le toripalimab en association et de 83,9 % pour la chimiothérapie seule et, chez les patients atteints de CEO, étaient de 24,9 % pour le toripalimab en association et de 13,6 % pour la chimiothérapie seule (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients.
Principales références :
- Mai HQ, Chen QY, Chen D, Hu C, Yang K, Wen J, Li J, Shi YR, Jin F, Xu R, Pan J, Qu S, Li P, Hu C, Liu YC, Jiang Y, He X, Wang HM, Lim WT, Liao W, He X, Chen X, Liu Z, Yuan X, Li Q, Lin X, Jing S, Chen Y, Lu Y, Hsieh CY, Yang MH, Yen CJ, Samol J, Feng H, Yao S, Keegan P, Xu RH. Toripalimab or placebo plus chemotherapy as first-line treatment in advanced nasopharyngeal carcinoma: a multicenter randomized phase 3 trial. Nat Med. 2021 Sep;27(9):1536-1543. doi: 10.1038/s41591-021-01444-0. Epub 2021 Aug 2. Erratum in: Nat Med. 2022 Jan;28(1):214. doi: 10.1038/s41591-021-01673-3. PMID: 34341578.
- Yuan SQ, Nie RC, Jin Y, Liang CC, Li YF, Jian R, Sun XW, Chen YB, Guan WL, Wang ZX, Qiu HB, Wang W, Chen S, Zhang DS, Ling YH, Xi SY, Cai MY, Huang CY, Yang QX, Liu ZM, Guan YX, Chen YM, Li JB, Tang XW, Peng JS, Zhou ZW, Xu RH, Wang F. Perioperative toripalimab and chemotherapy in locally advanced gastric or gastro-esophageal junction cancer: a randomized phase 2 trial. Nat Med. 2024 Feb;30(2):552-559. doi: 10.1038/s41591-023-02721-w. Epub 2024 Jan 2. Erratum in: Nat Med. 2024 Feb;30(2):605. doi: 10.1038/s41591-024-02800-6. PMID: 38167937
- Jiang Z, Ouyang Q, Sun T, Zhang Q, Teng Y, Cui J, Wang H, Yin Y, Wang X, Zhou X, Wang Y, Sun G, Wang J, Zhang L, Yang J, Qian J, Yan M, Liu X, Yi T, Cheng Y, Li M, Zang A, Wang S, Wang C, Wu X, Cheng J, Li H, Lin Y, Geng C, Gu K, Xie C, Xiong H, Wu X, Yang J, Li Q, Chen Y, Li F, Zhang A, Zhang Y, Wu Y, Nie J, Liu Q, Wang K, Mo X, Chen L, Pan Y, Fu P, Zhang H, Pang D, Sheng Y, Han Y, Wang H, Cang S, Luo X, Yu W, Deng R, Yang C, Keegan P. Toripalimab plus nab-paclitaxel in metastatic or recurrent triple-negative breast cancer: a randomized phase 3 trial. Nat Med. 2024 Jan;30(1):249-256. doi: 10.1038/s41591-023-02677-x. Epub 2024 Jan 8. PMID: 38191615.
- Mai HQ, Chen QY, Chen D, Hu C, Yang K, Wen J, Li J, Shi Y, Jin F, Xu R, Pan J, Qu S, Li P, Hu C, Liu YC, Jiang Y, He X, Wang HM, Lim WT, Liao W, He X, Chen X, Wang S, Yuan X, Li Q, Lin X, Jing S, Chen Y, Lu Y, Hsieh CY, Yang MH, Yen CJ, Samol J, Luo X, Wang X, Tang X, Feng H, Yao S, Keegan P, Xu RH. Toripalimab Plus Chemotherapy for Recurrent or Metastatic Nasopharyngeal Carcinoma: The JUPITER-02 Randomized Clinical Trial. JAMA. 2023 Nov 28;330(20):1961-1970. doi: 10.1001/jama.2023.20181. PMID: 38015220; PMCID: PMC10685882.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS : Pas de données à la date du 30/10/24
- Base de données publique des médicaments : Pas de données à la date du 30/10/24
- ANSM : Pas de données à la date du 30/10/24
- Meddispar : Pas de données à la date du 30/10/24
- Vidal : Pas de données à la date du 30/10/24
- Centre de référence sur les agents tératogènes (CRAT) : Pas de données à la date du 30/10/24
Remarque :
Création de la fiche : Lorie Nguyen
Dernière mise à jour : 30/10/2024
Relecture par : Pr C. Carnoy