Inebilizumab (UPLIZNA®)
Autre nom : inebilizumab-cdon
Structure : AcM IgG1 kappa humanisé
Code ATC : L04AA47
Cible: CD19
Mode de production : Produit dans des cellules ovariennes de hamster chinois (CHO) déficiente en fucosyltransférase par la technologie de l'ADN recombinant (POTELLIGENT® technology).
Forme galénique : Flacon contenant 100 mg d'inébilizumab dans 10 mL de solution à une concentration de 10 mg/mL. La concentration finale après dilution est de 1,0 mg/mL
Mode d'administration : IV
Date de la première AMM : EMA avril 2022 / FDA juin 2020
Laboratoires et lien vers xxx: Viela Bio ; Horizon Therapeutics
Indications : Indiqué en monothérapie dans le traitement des troubles du spectre de la neuromyélite optique (TSNMO) chez les patients adultes qui sont séropositifs pour les immunoglobulines G antiaquaporine-4 (AQP4-IgG)
Prix indicatif (année) : XXX
Usage : xxx
Posologies :
- La dose de charge recommandée est une perfusion intraveineuse de 300 mg (3 flacons de 100 mg) suivie d'une deuxième perfusion intraveineuse de 300 mg 2 semaines plus tard.
- La dose d'entretien recommandée est une perfusion intraveineuse de 300 mg tous les 6 mois. L'inébilizumab est utilisé en traitement chronique.
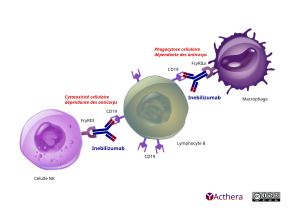
Mécanisme d'action :
L'inébilizumab se lie spécifiquement au CD19, l'antigène de surface présent sur les lymphocytes pré-B et B matures, y compris les plasmablastes et certains plasmocytes. Après la liaison de la surface cellulaire aux lymphocytes B, l'inébilizumab favorise la cytotoxicité cellulaire dépendante des anticorps (ADCC) et la phagocytose dépendante des anticorps (ADCP). Les lymphocytes B joueraient un rôle central dans la pathogenèse des TSNMO. Le mécanisme précis par lequel l'inébilizumab exerce ses effets thérapeutiques dans les TSNMO est inconnu, mais on suppose qu'il implique une déplétion en lymphocytes B et peut inclure la suppression de la sécrétion d'anticorps, de la présentation de l'antigène, de l'interaction entre les lymphocytes B et T et de la production de médiateurs inflammatoires.
Effets indésirables les plus fréquents : l'infection des voies urinaires (26,2 %), la rhinopharyngite (20,9 %), l'infection des voies aériennes supérieures (15,6 %), l'arthralgie (17,3 %) et la dorsalgie (13,8 %) à la fois sur la PCR et la PEO (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications :
• Hypersensibilité à la/aux substance(s) active(s) ou à l’un des excipients
• Infection active sévère, y compris infection chronique active telle que l'hépatite B
• Tuberculose latente active ou non traitée
• Antécédents de leucoencéphalopathie multifocale progressive (LEMP)
• Déficit immunitaire sévère
• Affections malignes évolutives
Principales références :
- Frampton JE. Inebilizumab: First Approval. Drugs. 2020 Aug;80(12):1259-1264. doi: 10.1007/s40265-020-01370-4. PMID: 32729016; PMCID: PMC7387876.
- Cree BAC, Bennett JL, Kim HJ, Weinshenker BG, Pittock SJ, Wingerchuk DM, Fujihara K, Paul F, Cutter GR, Marignier R, Green AJ, Aktas O, Hartung HP, Lublin FD, Drappa J, Barron G, Madani S, Ratchford JN, She D, Cimbora D, Katz E; N-MOmentum study investigators. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a double-blind, randomised placebo-controlled phase 2/3 trial. Lancet. 2019 Oct 12;394(10206):1352-1363. doi: 10.1016/S0140-6736(19)31817-3. Epub 2019 Sep 5. PMID: 31495497.
- Rensel M, Zabeti A, Mealy MA, Cimbora D, She D, Drappa J, Katz E. Long-term efficacy and safety of inebilizumab in neuromyelitis optica spectrum disorder: Analysis of aquaporin-4-immunoglobulin G-seropositive participants taking inebilizumab for ⩾4 years in the N-MOmentum trial. Mult Scler. 2022 May;28(6):925-932. doi: 10.1177/13524585211047223. Epub 2021 Oct 1. PMID: 34595983; PMCID: PMC9024030.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas disponible au 30 mai 2022)
- ANSM (pas disponible au 30 mai 2022)
- Meddispar (pas disponible au 30 mai 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 30 mai 2022)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 30 mai 2022
Relecture par :