Anifrolumab (SAPHNELO®)
Autre nom : anifrolumab-fnia
Structure : AcM humain de type IgG1κ
Code ATC : L04AA51
Nomenclature Ge : IgG1κ G1e9
Cible: sous-unité 1 du récepteur à l’interféron de type I (IFNAR1)
Mode de production : produit dans des cellules de myélome de souris (NS0) par la technologie de l’ADN recombinant
Forme galénique : Flacon de 2 mL de solution à diluer contenant 300 mg d’anifrolumab (150 mg/mL)
Mode d'administration : IV
Date de la première AMM : FDA juillet 2021 / EMA février 2022
Laboratoires : AstraZeneca AB
Indications : Lupus Erythémateux Systémique (LES)
Ce traitement est indiqué en traitement additionnel chez les patients adultes atteints d’un Lupus Erythémateux Systémique (LES) modéré à sévère, actif avec présence d’autoanticorps malgré un traitement standard à l'exclusion de la néphrite lupique active sévère et du lupus actif sévère du système nerveux central.
Dans les formes cutanées en échec du traitement standard, SAPHNELO représente une alternative à privilégier par rapport au thalidomide et au lénalidomide qui sont moins bien tolérés. On ne dispose pas de données permettant de situer la place de SAPHNELO dans la stratégie thérapeutique par rapport à BENLYSTA (belimumab), toutefois, selon un avis d'expert, SAPHNELO pourrait également avoir un intérêt en 3ème ligne de traitement après échec au belimumab.
Prix indicatif (année) : XXX
Usage : xxx
Posologies : La dose recommandée est de 300 mg, administrée par perfusion intraveineuse d’une durée de 30 minutes, toutes les 4 semaines.
Chez les patients ayant des antécédents de réactions liées à la perfusion, une prémédication (par exemple, un antihistaminique) peut être administrée avant la perfusion d’anifrolumab
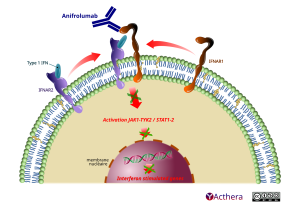
Mécanisme d'action :
Anifrolumab se lie au récepteur à l’interféron de type I (IFNAR1) et ainsi inhibe la signalisation de l’IFN de type I et bloque l'activité biologique des IFN de type I. L’anifrolumab induit également l’internalisation de l’IFNAR1, réduisant ainsi la quantité d’IFNAR1 présents à la surface cellulaire et disponibles en tant que récepteurs. Le blocage de la signalisation de l’IFN de type I médiée par le récepteur inhibe l’expression génique de l’IFN en réponse à cette signalisation, ainsi que les processus inflammatoires et immunologiques en aval.
L’inhibition de l’IFN de type I bloque la différenciation des plasmocytes et normalise les sous-ensembles de lymphocytes T périphériques, restaurant l'équilibre entre l’immunité adaptative et innée qui n’est plus régulé dans le lupus érythémateux systémique (LES)
Effets indésirables les plus fréquents : De graves réactions d'hypersensibilité, y compris une anaphylaxie, ont été rapportées après l'administration de l'anifrolumab. L'anifrolumab augmente le risque d'infections respiratoires et de zona (des événements de zona disséminé ont été observés).
(se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : xx
Principales références :
Morand EF, Furie R, Tanaka Y, Bruce IN, Askanase AD, Richez C, Bae SC, Brohawn PZ, Pineda L, Berglind A, Tummala R; TULIP-2 Trial Investigators. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020 Jan 16;382(3):211-221. doi: 10.1056/NEJMoa1912196. Epub 2019 Dec 18. PMID: 31851795.
Kalunian KC, Furie R, Morand EF, Bruce IN, Manzi S, Tanaka Y, Winthrop K, Hupka I, Zhang LJ, Werther S, Abreu G, Hultquist M, Tummala R, Lindholm C, Al-Mossawi H. A Randomized, Placebo-Controlled Phase III Extension Trial of the Long-Term Safety and Tolerability of Anifrolumab in Active Systemic Lupus Erythematosus. Arthritis Rheumatol. 2023 Feb;75(2):253-265. doi: 10.1002/art.42392. Epub 2022 Nov 11. PMID: 3636979
Bruce IN, van Vollenhoven RF, Morand EF, Furie RA, Manzi S, White WB, Abreu G, Tummala R. Sustained glucocorticoid tapering in the phase 3 trials of anifrolumab: a post-hoc analysis of the TULIP-1 and TULIP-2 trials. Rheumatology (Oxford). 2022 Aug 26:keac491. doi: 10.1093/rheumatology/keac491. Epub ahead of print. PMID: 36018235
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar
- Centre de référence sur les agents tératogènes (CRAT)
Remarque :
Dernière mise à jour : 01/02/2023
Relecture par : Emmanuel Hermann