Alemtuzumab (LEMTRADA®)
Attention :
En 2020, à la suite de signalements de réactions immunitaires et cardiovasculaires graves, pouvant aller jusqu’au décès, l’EMA a réévalué le rapport bénéfices-risques de Lemtrada® (Alemtuzumab) utilisé chez les patients adultes atteints d’une forme active de sclérose en plaques récurrente rémittente (SEP-RR) définie par des paramètres cliniques ou IRM. Il y a donc des restrictions d'indication, des contre-indications supplémentaires et mesures de réduction du risque
Autre nom : aussi connu sous le nom de Campath® en autorisation d'accès compassionnel (ou Mabcampath® aux USA)
Structure : AcM humanisé, IgG1k
Code ATC : L04AA34 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs sélectifs L04AA, Alemtuzumab L04AA34)
Nomenclature Ge : IgG1κ G1e0
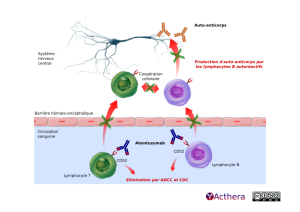
Cible: CD52
Mode de production : L'alemtuzumab est un anticorps monoclonal IgG1 kappa humanisé, obtenu par manipulation génétique, spécifique d'une glycoprotéine de 21-28 kD située à la surface des lymphocytes (CD52). Il est produit par la technologie de l'ADN recombinant à partir d’une suspension de cellules de mammifères (ovaire de hamster chinois CHO) en culture dans un milieu nutritif .
Forme galénique : Campath® 30mg/mL, solution à diluer pour perfusion. Lemtrada® 12 mg, solution à diluer pour perfusion.
Mode d'administration : IV /!\ Il est obligatoire d’administrer le traitement dans un hôpital bénéficiant d'un accès immédiat à des installations de soins intensifs et de spécialistes capables de prendre en charge les effets indésirables graves.
Conservation : Le flacon fermé se conserve 3 ans. Lorsque la solution est diluée : la stabilité physico-chimique de la solution diluée est de 8 heures à une température comprise entre 2°C et 8°C. D'un point de vue microbiologique, il est recommandé d'utiliser le produit immédiatement. Si la solution n’est pas utilisée immédiatement, la durée et les conditions de conservation relèvent de la responsabilité de l'utilisateur et ne doivent pas dépasser 8 heures à une température comprise entre 2°C et 8°C et à l'abri de la lumière.
Date de la première AMM : FDA 2001 / EMA 2013
Laboratoires : Genzyme Therapeutics
Indications :
- Sclérose en plaque : Restriction de l'utilisation de Lemtrada® chez les adultes atteints de sclérose en plaques rémittente et hautement active malgré un traitement adéquat avec au moins un traitement immunomodulateur ou si la maladie s'aggrave rapidement avec au moins deux poussées invalidantes par an et une imagerie cérébrale montrant de nouvelles lésions.
- Leucémie lymphoïde chronique (seulement aux USA)
Usage : Réservé à l'usage hospitalier : il est obligatoire d’administrer le traitement dans un hôpital bénéficiant d'un accès immédiat à des installations de soins intensifs et de spécialistes capables de prendre en charge les effets indésirables graves. La prescription de ce médicament est réservée aux spécialistes en neurologie.
Campath® est en AAC (autorisation d'accès compassionnel (juin 2022))
Posologies : La dose d’alemtuzumab recommandée est de 12 mg/jour administrée en perfusion intraveineuse au cours de 2 cycles initiaux de traitement et jusqu’à 2 cycles additionnels de traitement si nécessaire.
Premier cycle de traitement : 12 mg/jour pendant 5 jours consécutifs (dose totale de 60 mg)
Deuxième cycle de traitement : 12 mg/jour pendant 3 jours consécutifs (dose totale de 36 mg) administrés 12 mois après le premier cycle de traitement.
Mécanisme d'action :
L'alemtuzumab est un anticorps monoclonal humanisé anciennement utilisé dans la leucémie lymphoïde chronique sous le nom de Mabcampath®. Il a été retiré du marché par la filiale de Sanofi, Genzyme, pour des raisons commerciales. Le mécanisme d'action de l'alemtuzumab dans la sclérose en plaque n'est pas clairement élucidé mais l'anticorps a démontré, in vitro, sa capacité à exercer de l'ADCC et de la cytotoxicité du complément ce qui provoque une déplétion lymphocytaire périphérique. Une modification du nombre de lymphocytes T régulateurs, T et B mémoires a également été observée. Cette déplétion permettrait de réduire le risque des poussées.
Effets indésirables :
- Infections : infections fongiques, infections des voies respiratoires, leucoencéphalopathie multifocale progressive (rare)
- Effets survenant dans les 1 à 3 jrs après une perfusion de Lemtrada : Crise cardiaque, AVC, rupture de la paroi des vaisseaux, saignements, thrombopénie
- Effets indésirables retardés : troubles thyroïdiens (hyper ou hypothyroïdie), neutropénie, leucopénie, thrombopénie (PTI, PTT), atteintes rénales, hépatites auto-immunes, hémophilie acquise
Contre-indications : hypersensibilité au médicament, infection par le VIH.
Introduction de nouvelles contre-indications (2020) : Patients présentant certains troubles cardiaques (hypertension non contrôlée, ATCD de dissection artérielle cervico-encéphalique, ATCD d'AVC, d'angine de poitrine ou d'infarctus, coagulopathie) circulatoires ou hémorragiques (sous traitement anti-plaquettaire ou anticoagulant), et les patients présentant des troubles auto-immuns autres que la sclérose en plaques.
Principales références :
- Jones and Goldman, 2014), (Menge et al., 2014), (Hu et al., 2009)
Liens :
- Avis de la HAS sur Lemtrada
- Lien vers Human medicine European public assessment report (EPAR)
- ANSM :
Mise à jour du « guide à destination du médecin » et du « dossier d’information pour le patient » afin de réduire le risque de troubles cardiaques graves pouvant survenir peu de temps après la perfusion, ainsi que des affections auto-immunes pouvant survenir plusieurs mois après la dernière dose de Lemtrada.
- FDA
- Base de donnée des médicaments
- Vidal
- IMGT-DB
Remarque :
Dernière mise à jour : 09/22
Relecture par : Mathilde GLAZIOU