Brodalumab (KYNTHEUM®)
Autres noms : LUMICEF® (Japon) ; SILIQ® (USA)
Code ATC : L04AC12
Structure : AcM humain, IgG2
Nomenclature Ge : IgG1κ G2e0
Cible: interleukine 17 récepteur A (IL-17RA)
Mode d'administration : SC
Forme galénique : solution injectable en seringue préremplie de 1,5 ml (210 mg de brodalumab)
Date de la première AMM : FDA 2017 / EMA 2017
Laboratoires : LEO Pharma
Indications : traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique.
Essais cliniques : AMAGINE-1 (NCT01708590), AMAGINE-2 (NCT01708603), and AMAGINE-3 (NCT01708603)
Prix indicatif : 900,24 € (2021)
Usage : Médicament soumis à prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en dermatologie et en médecine interne. Disponible à l'officine en ville.
Posologies : La dose recommandée est de 210 mg en injection sous-cutanée, administrée aux semaines 0, 1 et 2, suivie de 210 mg toutes les deux semaines. En l'absence de réponse après 12 à 16 semaines de traitement, un arrêt du traitement doit être envisagé.
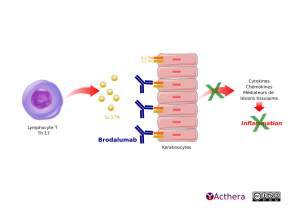
Mécanisme d'action :
Le brodalumab se lie avec une affinité élevée à l'IL-17RA humaine et bloque l'activité biologique des cytokines pro-inflammatoires IL-17A, IL-17F, hétérodimère IL-17A/F et IL-25, ce qui entraîne l'inhibition de l'inflammation et des symptômes cliniques associés au psoriasis. On a rapporté une augmentation des concentrations de cytokines de la famille IL-17 en cas de psoriasis. L'IL-17A, l'IL-17F et l'hétérodimère IL-17A/F ont des activités pléiotropiques, notamment l'induction de médiateurs pro-inflammatoires tels que l'IL-6, le GROα et le G-CSF dans les cellules épithéliales, endothéliales et les fibroblastes, qui favorisent l'inflammation tissulaire. La neutralisation de l'IL-17RA inhibe les réponses induites par les cytokines IL-17, ce qui normalise l'inflammation cutanée.
Effets indésirables les plus fréquents: arthralgie, céphalée, fatigue, diarrhée et douleur oropharyngée
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients ; infections évolutive et cliniquement graves (par exemple une tuberculose active) ; Maladie de Crohn active.
Principales références :
- Bibliographie
Fargnoli MC, Esposito M, Dapavo P, Parodi A, Rossi M, Tiberio R, Dastoli S, Offidani AM, Argenziano G, Gisondi P, Lo Schiavo A, Loconsole F, Pella P, Bardazzi F, Cusano F, Gattoni M, Nacca M, Cannavò SP, Pellegrini C, Costanzo A; BRILLIANT Working Group. Brodalumab for the treatment of moderate-to-severe plaque-type psoriasis: a real-life, retrospective 24-week experience. J Eur Acad Dermatol Venereol. 2021 Mar;35(3):693-700. doi: 10.1111/jdv.16931. Epub 2020 Oct 13. PMID: 32916767.
Seo SJ, Shin BS, Lee JH, Jeong H. Efficacy and safety of brodalumab in the Korean population for the treatment of moderate to severe plaque psoriasis: A randomized, phase III, double-blind, placebo-controlled study. J Dermatol. 2021 Jun;48(6):807-817. doi: 10.1111/1346-8138.15733. Epub 2020 Dec 29. PMID: 33373480; PMCID: PMC8246806.
Galluzzo M, Caldarola G, De Simone C, Bernardini N, Moretta G, Pallotta S, Botti E, Campione E, Pirro F, Potenza C, Bianchi L, Peris K. Use of brodalumab for the treatment of chronic plaque psoriasis: a one-year real-life study in the Lazio region, Italy. Expert Opin Biol Ther. 2021 Jun 28:1-11. doi: 10.1080/14712598.2021.1941862. Epub ahead of print. PMID: 34114515.
Liens
- Avis de la HAS sur Kyntheum
- Human medicine European public assessment report (EPAR)
- Fiche info de la base de données publique des médicaments : https://base-donnees-publique.medicaments.gouv.fr/extrait.php?specid=65620419
- HeTOP
- IMGT-DB
- Vidal
Remarque :
Dernière mise à jour : 23/07/21
Relecture par : Dr Patricia De Nadai