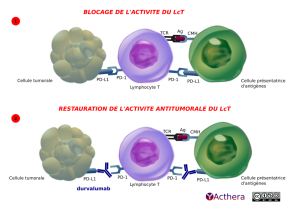
Durvalumab (IMFINZI®)
Structure : AcM humain, IgG1k
Code ATC : L01XC28
Nomenclature Ge : IgG1κ G1e9
Cible: PD-L1
Mode de production : Le durvalumab est produit dans une lignée cellulaire de mammifères (ovaire de hamster chinois) par la technique de l’ADN recombinant.
Forme galénique : Solution à diluer pour perfusion 50 mg/mL (flacon de 2,4 mL avec 120 mL de durvalumab ou 10 mL avec 500 mg de durvalumab).
Mode d'administration : IV
Conservation : La stabilité physico-chimique de la solution diluée a été démontrée pendant une durée allant jusqu'à 30 jours à une température comprise entre 2 °C et 8 °C et jusqu'à 24 heures à température ambiante (ne dépassant pas 25 °C) à partir de la préparation. D'un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. En cas d'utilisation non immédiate, les durées de conservation après dilution et les conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur et le produit peut être conservé pendant un maximum de 30 jours à une température comprise entre 2 °C et 8 °C ou 12 heures à température ambiante (ne dépassant pas 25 °C).
Date de la première AMM : EMA septembre 2018 (2022 pour le cancer des voies biliaires) / FDA 2017
Laboratoires : AstraZeneca AB
Indications :
- Cancer bronchique non à petite cellule
En monothérapie dans le traitement des patients adultes atteints d'un cancer de stade 3 localement avancé, non opérable, dont les tumeurs expriment PD-L1 ≥ 1% des cellules tumorales et dont la maladie n'a pas progressé après une chimioradiothérapie à base de platine.
En association avec le trémélimumab et une chimiothérapie à base de platine, dans le traitement de première ligne des patients adultes atteints d’un CBNPC métastatique en l’absence de mutation activatrice de l’EGFR ou de ALK.
- Cancer bronchique à petites cellules
En association à l’étoposide et au carboplatine ou au cisplatine, est indiqué dans le traitement de première intention des patients adultes atteints d'un cancer bronchique à petites cellules à un stade étendu (CBPC-SE).
- Cancer des voies biliaires : en association avec la gemcitabine et le cisplatine pour le traitement de première ligne des patients adultes atteints d'un cancer des voies biliaires (CVB) non résécable ou métastatique.
- Carcinome hépatocellulaire : En association avec le trémélimumab, dans le traitement de première ligne des patients adultes atteints d’un carcinome hépatocellulaire (CHC) avancé ou non résécable.
Prix indicatif (janvier 2023) : 472,531 euros pour un flacon de 2,4 mL, 1968,880 euros pour un flacon de 10 mL.
Usage : Médicament réservé à l'usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement. Pas de disponibilité en ville.
Posologie :
- En monothérapie, 10 mg/kg toutes les 2 semaines ou 1 500 mg toutes les 4 semaines (durée maximale de 12 mois).
- 1500 mg en association avec une chimiothérapie toutes les 3 semaines (21 jours) pendant 4 cycles, suivi de 1 500 mg toutes les 4 semaines en monothérapie.
- En perfusion d'une heure.
Mécanisme d'action :
Le durvalumab n'induit pas de cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC).
Effets indésirables les plus fréquents : Infections, hypothyroïdie, diarrhées et douleurs abdominales, éruptions cutanées, arthralgies, réactions au point d'injection.
Contre indication : Hypersensibilité à la substance.
Utilisation chez la femme enceinte : Les femmes en âge de procréer doivent utiliser une méthode efficace de contraception pendant toute la durée du traitement par le durvalumab et la poursuivre pendant au moins 3 mois après la dernière administration de durvalumab. Aucune donnée n'est disponible sur l'utilisation du durvalumab chez la femme enceinte. Sur la base de son mécanisme d’action, le durvalumab peut potentiellement impacter l’évolution de la grossesse. Dans un modèle murin allogénique de grossesse, la perturbation de la voie de signalisation PD-L1 a conduit à une augmentation des pertes fœtales. Les études chez l’animal sur le durvalumab n’ont pas révélé de reprotoxicité.
Principales références
-
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur IMFINZI
- IMGT/DB
Remarque :
Dernière mise à jour : Novembre 2023
Par : Mathilde GLAZIOU