Brolucizumab (BEOVU®)
Structure : Fragment scFv d'un anticorps humanisé (poids moléculaire d'environ 26 kDa)
Code ATC : S01LA06
Cible: VEGF-A
Mode de production : fragment produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique :
Solution injectable en seringue préremplie à 120 mg/mL (19,8 mg de brolucizumab dans 0,165 mL de solution). Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 ml de solution contenant 6 mg de brolucizumab.
Solution injectable à 120mg/mL (27,6 mg de brolucizumab dans 0,23 mL de solution). Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 ml de solution contenant 6 mg de brolucizumab.
Mode d'administration : injection intravitréenne
Date de la première AMM : FDA 2019 / EMA Février 2020
Laboratoires : Novartis Europharm Limited
Indications :
- Traitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l'âge (DMLA) (études HAWK et HARRIER)
Prix indicatif (janvier 2024): 464,30 euros pour une seringue pré-remplie
Usage : Prescription restreinte aux spécialistes en ophtalmologie. Médicament d'exception.
Posologies :
La dose recommandée de brolucizumab est de 6 mg (0,05 ml de solution) administrée toutes les 6 semaines pour les 5 premières doses. Ensuite, le médecin peut individualiser les intervalles de traitement (8 ou 12 semaines) selon l'activité de la maladie, évaluée par la mesure de l'acuité visuelle et/ou des critères anatomiques. Une évaluation de l'activité de la maladie est suggérée 16 semaines (4 mois) après le début du traitement :
- Chez les patients sans activité de la maladie, un traitement toutes les 12 semaines (3 mois) doit être envisagé.
- Chez les patients présentant une activité de la maladie, un traitement toutes les 8 semaines (2 mois) doit être considéré.
Les intervalles de traitement peuvent ensuite être individualisés par le médecin en se basant sur l'activité de la maladie.
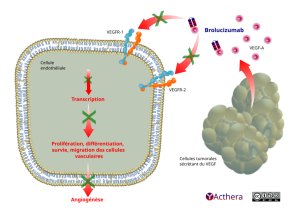
Mécanisme d'action :
La dégénérescence maculaire liée à l'âge (DMLA) néovasculaire (humide) se caractérise par une néovascularisation choroïdienne (NVC) pathologique. La fuite de sang et de fluide des NVC peut causer un épaississement de la rétine, ou un oedème rétinien, et/ou une hémorragie intrarétinienne/ sous-rétinienne, résultant en une perte d'acuité visuelle.
Une surexpression de la voie du facteur de croissance de l'endothélium vasculaire humain de type A (VEGF-A) est associée à une angiogenèse oculaire et à un oedème rétinien pathologiques. Le brolucizumab se lie avec une haute affinité aux isoformes du VEGF-A (p.ex. VEGF110, VEGF121 et VEGF165), empêchant dès lors la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2. En inhibant la liaison du VEGF-A à ses récepteurs, le brolucizumab supprime la prolifération des cellules endothéliales et, par conséquent, réduit la néovascularisation ainsi que la perméabilité vasculaire.
Effets indésirables les plus fréquents : baisse d’acuité visuelle (7,3%), cataracte (7,0%), hémorragie conjonctivale (6,3%) et corps flottants vitréens (5,1%)
Contre-indications : Hypersensibilité à la substance active ou aux excipients, infection oculaire active ou suspectée, inflammation intra-oculaire active
Principales références :
Dugel PU, Koh A, Ogura Y, et al. HAWK and HARRIER: Phase 3, Multicenter, Randomized, Double-Masked Trials of Brolucizumab for Neovascular Age-Related Macular Degeneration. Ophthalmology. 2020;127(1):72-84. doi:10.1016/j.ophtha.2019.04.017
Yannuzzi NA, Freund KB. Brolucizumab: evidence to date in the treatment of neovascular age-related macular degeneration. Clin Ophthalmol. 2019;13:1323-1329. Published 2019 Jul 24. doi:10.2147/OPTH.S184706
Al-Khersan H, Hussain RM, Ciulla TA, Dugel PU. Innovative therapies for neovascular age-related macular degeneration. Expert Opin Pharmacother. 2019;20(15):1879-1891. doi:10.1080/14656566.2019.1636031
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- IMGT
- Avis de la HAS d'août 2023
- FDA
- Vidal
- Base de donnée publique des médicaments
- HeTop
- Livret patient sous Beovu (ANSM)
- CRAT : pas de données au 13/01/24
- Meddispar : pas de données au 13/01/24
Remarque :
Dernière mise à jour : Janvier 2024
Par : Mathilde Glaziou