Canakinumab (ILARIS®)
Structure : AcM humain, IgG1k
Code ATC : L04AC08
Nomenclature Ge : IgG1κ G1e0
Cible: IL-1β
Mode de production : produit sur myélome murin de cellules Sp2/0 par technique de l’ADN recombinant.
Forme galénique : Poudre pour solution injectable 150 mg/mL (flacon)
Mode d'administration : SC
Conservation : Le produit se conserve au réfrigérateur et doit être utilisé immédiatement après ouverture.
Date de la première AMM : FDA 2009 / EMA 2009
Laboratoires : Novartis Pharmaceuticals Corp
Indications :
- Traitement des syndromes de fièvres périodiques auto-inflammatoires chez les adultes, les adolescents et les enfants de plus de 2 ans
-> Traitement des syndromes périodiques associés à la cryopyrine (CAPS) comprenant :
Le syndrome de Muckle-Wells (MWS)
La maladie systémique inflammatoire à début néo-natal (NOMID) et le syndrome chronique infantile neurologique, cutané et articulaire (CINCA)
Maladie systémique inflammatoire à début néo-natal (NOMID)
Les formes sévères du syndrome familial auto-inflammatoire au froid (FCAS) ou urticaire familiale au froid (FCU), présentant une symptomatologie ne se limitant pas à l’éruption urticarienne induite par le froid.
-> Traitement du syndrome périodique associé au récepteur du facteur de nécrose tumorale (TNF) (TRAPS).
-> Traitement du syndrome de l'hyperimmunoglobulinémie D (HIDS) et le déficit en mévalonate kinase (MKD)
-> Traitement de la fièvre méditerranéenne familiale (FMF). Ilaris* peut être utilisé en association avec la colchicine, le cas échéant.
- Traitement de la maladie de Still active comprenant la maladie de Still de l'adulte (MSA) et l'arthrite juvénile idiopathique systémique (AJIs) chez les patients âgés de 2 ans et plus, qui ont présenté une réponse inadéquate à un précédent traitement par anti-inflammatoires non stéroïdiens (AINS) et par corticoïdes systémiques. Ilaris* peut être utilisé en monothérapie ou en association au méthotrexate.
-Traitement symptomatique des patients adultes présentant des crises fréquentes d'arthrite goutteuse (au moins 3 crises au cours des 12 mois précédents) chez qui les anti-inflammatoires non stéroïdiens (AINS) et la colchicine sont contre-indiqués, mal tolérés ou n'entraînent pas de réponse suffisante et chez qui des cures répétées de corticoïdes ne sont pas appropriées.
Prix indicatif : 11363,88 € le flacon de 150 mg pour 1 ml
Usage : Médicament soumis à prescription hospitalière. Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en médecine interne, en dermatologie ou en pédiatrie. Médicament d'exception nécessitant une surveillance particulière pendant le traitement. Médicament disponible en ville.
Posologies :
Adultes, adolescents et enfants de plus de 4 ans :
150 mg chez les patients pesant strictement plus de 40 kg
2 mg/kg chez les patients pesant entre 15 kg et 40 kg
4 mg/kg chez les patients pesant entre 7,5 kg et 15 kg.
Enfants âgés de 2 à 4 ans :
4 mg/kg chez les patients pesant au moins 7,5 kg.
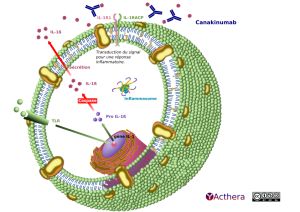
Mécanisme d'action :
Le CAPS est associé à des mutations du gène CIAS1 codant pour la cryopyrine (inflammasome), qui régule la production d'IL-1β via la caspase 1 et intervient dans le contrôle de l'immunité innée. Chez les patients atteints de CAPS, une production continue d'IL1β est observée induisant une situation d'auto-inflammation. Le canakinumab est le premier traitement autorisé pour les malades atteints de CAPS. Le canakinumab se lie avec une haute affinité à l'IL-1 bêta humaine et neutralise son activité biologique en inhibant son interaction avec les récepteurs à l'IL-1, empêchant ainsi l'activation génique induite par l'IL-1 bêta et la synthèse de médiateurs inflammatoires. En liant l'IL-1β, il permet de contrer l'amplification de l'inflammation.
Effets indésirables les plus fréquents: infections des voies respiratoires supérieures (pneumonie, rhinopharyngite), douleurs abdominales hautes, réaction au site d’injection, arthralgie, diminution de la clairance rénale de la créatinine, protéinurie, leucopénie
Contre-indications : hypersensibilité au médicament, infections sévères évolutives
Principales références :
Liens :
- Avis de la HAS sur Ilaris
- Lien vers Human medicine European public assessment report (EPAR)
- Lien vers la fiche info de la base de données publique des médicaments
- IMGT
- HeTOP
- Vidal
Remarque :
Dernière mise à jour : Octobre 2022
Relecture par : Mathilde GLAZIOU