Mirikizumab (OMVOH®)
Autres noms : mirikizumab-mrkz
Structure : AcM humanisé de type IgG4 kappa
Code ATC : L04AC24
Nomenclature Ge : xxx
Cible: IL-23p19
Mode de production : Produit dans des cellules ovariennes de hamster chinois (CHO) par la technologie de l'ADN recombinante.
Forme galénique :
- Solution à diluer pour perfusion (300 mg)
- Solution injectable en stylo ou seringue pré-remplie (100 mg)
Mode d'administration : IV/SC
Date de la première AMM : FDA avril 2023 / EMA mai 2023
Laboratoire : Eli Lilly
Indications :
Ce biomédicament est indiqué pour le traitement des patients adultes atteints de rectocolite hémorragique modérément à sévèrement active qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance à un traitement conventionnel ou à un traitement biologique.
Prix indicatif (année) : xxx
Usage : Depuis avril 2024, fait partie des biothérapies pouvant être initiée par un spécialiste en ville (pour l'injection SC)
Posologies :
La dose d’induction est de 300 mg en perfusion IV pendant au moins 30 minutes aux semaines 0, 4 et 8. La dose d'entretien est de 200 mg (c'est-à-dire deux seringues préremplies ou deux stylos préremplis) par injection SC toutes les 4 semaines après la fin du traitement d'induction.
Mécanisme d'action :
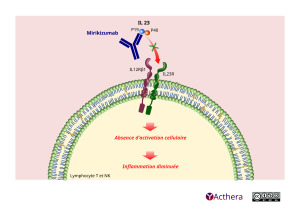
Mirikizumab est un anticorps monoclonal humanisé IgG4 anti-interleukine-23 (anti-IL-23) qui se lie sélectivement à la sous-unité p19 de la cytokine humaine IL-23 et inhibe son interaction avec le récepteur de l'IL-23.
L'IL-23, une cytokine régulatrice, affecte la différenciation, l'expansion et la survie des sous-ensembles de cellules T.
Chez l'homme, il a été démontré que le blocage sélectif de l'IL-23 permettait de normaliser la production de ces cytokines.
Effets indésirables les plus fréquents : infections des voies respiratoires supérieures (7,9 %, le plus
fréquemment des rhinopharyngites), céphalées (3,3 %), éruptions cutanées (1,1 %) et réactions au site d'injection (8,7 %)
(se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l'un des excipients, infection active (tuberculose active)
Principales références :
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments - pas de donnée au 12/07/24
- ANSM - pas de donnée au 12/07/24
- Meddispar - pas de donnée au 12/07/24
- Vidal - pas de donnée au 12/07/24
- Centre de référence sur les agents tératogènes (CRAT) - pas de donnée au 12/07/24
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : Juillet 2024
Relecture par : Mathilde Glaziou