Golimumab (SIMPONI®)
Structure : AcM humain, IgG1k
Code ATC : L04AB06 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AB Inhibiteurs du facteur de nécrose tumorale alpha (TNF-alpha) L04AB06 Golimumab)
Nomenclature Ge : IgG1κ G1e0
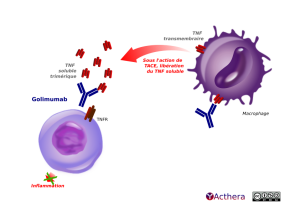
Cible: TNF (tumor necrosis factor) soluble et membranaire
Mode de production : Anticorps monoclonal humain de type IgG1κ produit sur une lignée cellulaire d'hybridome de souris par la technique de l'ADN recombinant.
Forme galénique : Seringue (50 ou 100mg) ou stylo (50 ou 100 mg) préremplis
Mode d'administration : SC
Conservation : A conserver au réfrigérateur entre 2 et 8°C (ne pas congeler). Simponi peut être conservé à des températures allant jusqu'à 25 °C maximum pendant une période unique allant jusqu'à 30 jours, mais sans dépasser la date de péremption initiale imprimée sur l'emballage. Dès lors que Simponi a été conservé à température ambiante, il ne doit pas être remis en conditions réfrigérées. Simponi doit être jeté s'il n'est pas utilisé dans les 30 jours de conservation à température ambiante
Date de la première AMM : EMA 2009 - extension d'indication en 2013 pour PAR et et rectocolite hémorragique et extension de 2020 pour l'arthrite juvénile idiopathique / FDA 2009
Laboratoires : Janssen Biologics B.V. / MSD France
Indications :
- Spondylarthrite ankylosante :
Spondylarthrite ankylosante (SA) : Simponi est indiqué pour le traitement de la spondylarthrite ankylosante sévère et active chez les adultes qui ont répondu de manière inadéquate au traitement conventionnel.
Spondyloarthrite axiale non radiographique (SpA nr-Axiale) : Simponi est indiqué dans le traitement des adultes souffrant de spondylarthrite axiale non radiographique active et sévère, avec des signes objectifs d'inflammation tels qu'indiqués par une élévation de la protéine C-réactive (CRP) et/ou des signes d'imagerie par résonance magnétique (IRM), qui ont eu une réponse inadéquate ou sont intolérants aux anti-inflammatoires non stéroïdiens (AINS).
Simponi, seul ou en association avec le MTX, est indiqué pour le traitement du rhumatisme psoriasique actif et progressif chez les patients adultes lorsque la réponse au traitement DMARD précédent n'a pas été suffisante.
Simponi, en association avec le méthotrexate (MTX), est indiqué pour :
le traitement de la polyarthrite rhumatoïde active, modérée à sévère, chez l'adulte lorsque la réponse au traitement par les antirhumatismaux modificateurs de la maladie (DMARD), y compris le MTX, est inadéquate.
Le traitement de la polyarthrite rhumatoïde sévère, active et évolutive chez l'adulte qui n'a pas été précédemment traités par MTX.
Simponi est indiqué pour le traitement de la rectocolite hémorragique modérément à sévèrement active chez les patients adultes qui n'ont pas répondu de manière satisfaisante au traitement conventionnel comprenant des corticostéroïdes et de la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou qui sont intolérants ou présentent des contre-indications médicales à ces thérapies.
- Arthrite juvénile idiopathique :
Simponi en association avec le méthotrexate (MTX) est indiqué dans le traitement de l'arthrite juvénile idiopathique polyarticulaire chez les enfants âgés de 2 ans et plus, qui n'ont pas répondu de façon adéquate à un à un traitement antérieur par MTX
Prix indicatif (2022) : 699,87 euros pour 100 mg ou 50 mg sous forme stylo ou seringue
Usage : Prescription initiale hospitalière annuelle. Médicament d'exception. Prescription initiale et renouvellement réservé à certains spécialistes : dermatologie, hépato et gastro-entérologie, médecine interne, pédiatrie et rhumatologie. Disponible à l'officine.
Posologies : 50 mg/mois à la même date chaque mois. Pour la polyarthrite rhumatoïde, le golimumab doit être administré en même temps que le méthotrexate. Les données disponibles suggèrent que la réponse clinique est généralement obtenue dans un délai de 12 à 14 semaines de traitement (après 3-4 doses).
Pour les patients dont le poids corporel est de plus de 100 kg et qui n'obtiennent pas une réponse clinique adéquate après 3 ou 4 doses, une augmentation de la dose de golimumab à 100 mg une fois par mois peut être envisagée, en tenant compte du risque accru de certains effets indésirables graves avec la dose de 100 mg par rapport à 50 mg.
Pour la RCH : Dose initiale de 200 mg, suivie de 100 mg à la semaine 2. Les patients qui présentent une réponse adéquate doivent recevoir 50 mg à la semaine 6 et toutes les 4 semaines par la suite (100mg pour les plus de 80 kg)
Pour les enfants de moins de 40 kg atteints d'arthrite juvénile idiopathique polyarticulaire est de 30 mg/m2 de surface corporelle jusqu'à une dose unique maximale de 40 mg, à administrer 1 fois/mois. Pour les enfants atteints d'AJI dont le poids corporel est d'au moins 40 kg, un stylo ou une seringue préremplie de 50 mg est disponible (50mg/mois à la même date).
Mécanisme d'action :
Le golimumab, qui se lie aux formes solubles et membranaires du TNF, inhibe l'activité du TNF ce qui permet l'inhibition de l'activation de la voie NF-kB impliquée dans la synthèse de cytokines pro-inflammatoires. La cascade inflammatoire est bloquée : diminution de l'expression de molécules d'adhésion réduisant le processus de diapédèse et de recrutements des macrophages, des lymphocytes et des neutrophiles.
Effets indésirables les plus fréquents: Infections des voies respiratoires hautes (nasopharyngite, pharyngite, laryngite et rhinite)
Contre-indications : Hypersensibilité au médicament, insuffisance cardiaque, infections opportunistes telles que la tuberculose
Elimination complète du médicament : La demi-vie d’élimination plasmatique est longue (14 jours en moyenne), soit une élimination complète en environ 2 mois.
Utilisation chez la femme enceinte : Les données publiées chez les femmes enceintes exposées au golimumab au 1er trimestre de la grossesse sont peu nombreuses mais aucun élément inquiétant n’a été rapporté à ce jour. Ceci est cohérent avec l’analogie structurelle entre le golimumab et les IgG1 natives, dont le passage placentaire ne débute qu’à partir de 14 semaines d’aménorrhée (SA) environ, c’est-à-dire après la fin de l’organogenèse (10 SA). De plus, pour d’autres anticorps monoclonaux anti TNF-α de structure similaire (infliximab et adalimumab), les données publiées chez les femmes enceintes exposées au 1er trimestre de la grossesse sont très nombreuses et rassurantes. Le golimumab passe le placenta. A la naissance, les concentrations plasmatiques néonatales sont supérieures aux concentrations plasmatiques maternelles. Les données publiées chez des femmes enceintes exposées au golimumab au 2ème et/ou du 3ème trimestre de la grossesse sont très peu nombreuses mais aucun effet particulier attribuable au traitement n’est retenu chez les enfants. Donc on conseille une consultation pré-conceptionnelle pour faire le point sur la pathologie. Le golimumab peut être poursuivi pendant la grossesse en tenant compte du risque de l'immunosuppression du traitement.
Il n’y a quasiment pas de donnée publiée sur golimumab et allaitement. Le suivi d’environ 300 enfants allaités en moyenne 7 mois par des mères sous anti TNF-α de même structure (infliximab et adalimumab), ne met pas en évidence d’augmentation des infections pendant leurs 12 premiers mois de vie.
Principales références :
- Smolen et al., 2009 ; Singh et al., 2010
Liens :
- Fiche médicament du golimumab sur le site GETAID
- Avis de la HAS sur Simponi
- Lien vers Human medicine European public assessment report (EPAR)
- FDA (pharmacovigilance pédiatrique)
- CRAT
- Vidal
Remarque :
Dernière mise à jour : 08/22
Relecture par : Mathilde GLAZIOU