Adalimumab (IMRALDI®) - Biosimilaire
Attention :
Nouvelle formulation d'IMRALDI : Depuis le 2 novembre 2022, le laboratoire a commercialisé une nouvelle formulation d'IMRALDI®, plus concentrée (volume d'injection de 0,4 mL pour un même dosage de 40 mg) et sans citrate. Avec cette nouvelle formulation, IMRALDI présente une stabilité prolongée à température ambiante (≥ 25 °C) de 31 jours au lieu de 28 jours sur l'autre formulation.
Ces 2 formulations vont co-exister jusqu'à écoulement des stocks de la précédente formulation.
Structure : AcM humain, IgG1k
Code ATC : L04AB04 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AB Inhibiteurs du facteur de nécrose tumorale alpha (TNF-alpha) L04AB04 Adalimumab)
Nomenclature Ge : IgG1κ G1e0
Cible:TNF (tumor necrosis factor) soluble et membranaire
Mode de production : Anticorps monoclonal humain recombinant produit dans des cellules ovariennes de hamster chinois.
Forme galénique : Solution injectable (limpide, incolore) - seringue (40 mg) ou stylo (40 mg)
Mode d'administration : SC
Conservation : A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. Conserver la seringue préremplie ou le stylo prérempli dans son emballage extérieur à l'abri de la lumière. Une seringue préremplie ou un stylo prérempli d'Imraldi peut être maintenu à des températures allant jusqu'à 25°C pendant 14 jours maximum à l'abri de la lumière. Après cette période, le médicament doit être jeté
Date de la première AMM : EMA août 2017
Laboratoires : Samsung Bioepis NL B.V.
Indications : Utilisé dans le traitement de fond de plusieurs maladies chroniques :
- Polyarthrite rhumatoïde : Imraldi en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate et le traitement de la polyarthrite rhumatoïde sévère, active et évolutive chez les adultes non précédemment traités par le méthotrexate.
- Arthrite juvénile idiopathique : Imraldi en association au méthotrexate est indiqué pour le traitement de l'arthrite juvénile idiopathique polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de fond. Imraldi peut être administré en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée. Imraldi est indiqué pour le traitement de l'arthrite active liée à l'enthésite chez les patients à partir de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel.
- Spondyloarthrite axiale : Imraldi est indiqué pour le traitement de la spondylarthrite ankylosante sévère et active chez l'adulte ayant eu une réponse inadéquate au traitement conventionnel et dans le traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d'inflammation à l'IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens.
- Rhumatisme psoriasique : Imraldi est indiqué pour le traitement du rhumatisme psoriasique actif et évolutif chez l'adulte lorsque la réponse à un traitement de fond antérieur a été inadéquate.
- Psoriasis : Imraldi est indiqué dans le traitement du psoriasis en plaques chronique, modéré à sévère, chez les patients adultes qui nécessitent un traitement systémique. Imraldi est aussi indiqué dans le traitement du psoriasis en plaques chronique sévère chez les enfants à partir de 4 ans et les adolescents en cas de réponse insuffisante à un traitement topique et aux photothérapies ou lorsque ces traitements sont inappropriés.
- Hidrosadénite suppurée (HS) : Imraldi est indiqué dans le traitement de l'hidrosadénite suppurée (maladie de Verneuil) active, modérée à sévère, chez les adultes et les adolescents à partir de 12 ans en cas de réponse insuffisante au traitement systémique conventionnel de l'HS .
- Maladie de Crohn : Imraldi est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les patients adultes qui n'ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement est contre-indiqué ou mal toléré. Imraldi est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les enfants et les adolescents à partir de 6 ans, qui n'ont pas répondu à un traitement conventionnel comprenant un traitement nutritionnel de première intention et un corticoïde et/ou un immunomodulateur, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
- Rectocolite hémorragique : Imraldi est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients adultes ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou chez lesquels ce traitement est contre-indiqué ou mal toléré.
- Uvéite : Imraldi est indiqué dans le traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée.
Prix indicatif (juin 2022) : 469,03€ pour 2 stylos ou seringues préremplis de 40 mg
Usage : Prescription initiale hospitalière annuelle, médicament d'exception. Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en pédiatrie, en médecine interne, en gastroentérologie et hépatologie, en dermatologie ou en ophtalmologie. Disponible à l'officine.
Posologie :
Polyarthrite rhumatoïde : Une dose unique de 40 mg d'adalimumab administrée toutes les deux semaines. L'administration de méthotrexate doit être continuée pendant le traitement par Imraldi. En monothérapie, certains patients chez qui l'on observe une diminution de leur réponse à Imraldi peuvent bénéficier d'une augmentation de la posologie à 40 mg d'adalimumab toutes les semaines.
Spondylarthrite ankylosante, spondyloarthrite axiale sans signes radiographiques de SA et rhumatisme psoriasique : 40 mg d'adalimumab en dose unique toutes les deux semaines. Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement.
Psoriasis : La posologie recommandée d'Imraldi pour débuter le traitement chez l'adulte est de 80 mg par voie sous-cutanée. La posologie se poursuivra une semaine après par 40 mg en voie sous-cutanée une semaine sur deux.
Hidrosadénite suppurée : Une dose initiale de 160 mg au jour 1 (4 injections de 40 mg sur un jour ou de 2 injections de 40 mg par jour pendant deux jours consécutifs), suivie d'une dose de 80 mg deux semaines après, au jour 15 (2 injections de 40 mg sur un jour). Deux semaines plus tard (jour 29), poursuivre avec une dose de 40 mg chaque semaine.
Maladie de Crohn : Chez les patients adultes atteints de la maladie de Crohn active modérée à sévère, le schéma posologique d'induction recommandé d'Imraldi est de 80 mg à la semaine 0, suivis de 40 mg à la semaine 2. Après le traitement d'induction, la posologie recommandée est une dose de 40 mg administrée toutes les deux semaines.
Rectocolite hémorragique : Chez les patients adultes atteints de rectocolite hémorragique modérée à sévère, le schéma posologique d'induction recommandé d'Imraldi est de 160 mg à la semaine 0 (4 injections par jour ou de 2 injections par jour pendant deux jours consécutifs) et de 80 mg à la semaine 2. Après le traitement d'induction, la posologie recommandée est de 40 mg administrée toutes les deux semaines.
Uvéite : Une dose initiale de 80 mg suivie d'une dose de 40 mg toutes les deux semaines en commençant une semaine après l'administration de la première dose. Le traitement par Imraldi peut être débuté en association avec une corticothérapie et/ou avec d'autres traitements immunomodulateurs non biologiques.
Mécanisme d'action :
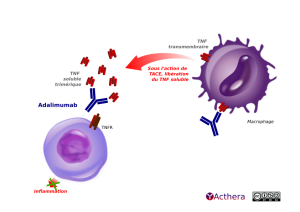
L'adalimumab bloque le TNF trimérique soluble et membranaire, ce qui empêche l'interaction avec les récepteurs p55 (TNFR1) et p75 (TNFR2) situés à la surface cellulaire, qui aurait permis l'activation de la voie NF-kB avec synthèse de cytokines pro-inflammatoires. La cascade inflammatoire est ainsi bloquée : diminution de l'expression de molécules d'adhésion diminuant ainsi le processus de diapédèse, et de recrutements de macrophages, lymphocytes et neutrophiles.
En haut, à droite, un macrophage porteur de deux TNF transmembranaires. L’un des TNF est à gauche sur la membrane. Un second TNF transmembranaire se trouve en bas de la membrane. Il est en contact avec un anticorps adalimumab (anticorps I g G 1 humain) qui bloque son action.
Plus bas à gauche, un lymphocyte T exprime un récepteur du TNF (légendé TNFR).
Une flèche courbe part du TNF, présent sur la gauche de la membrane du macrophage, elle pointe vers les TNF solubles trimériques situés au-dessus du lymphocyte T. Elle porte la légende : « Sous l'action de TACE, libération du TNF soluble » (TACE est l'enzyme de conversion du TNF alpha).
L'adalimumab se lie aux TNF solubles trimériques qui essaient de se connecter au TNFR présent sur la membrane du lymphocyte T. Une flèche barrée d’une croix hors du lymphocyte T, pointe sur le mot « Inflammation », attestant la réduction de l’inflammation par l’adalimumab.
Effets indésirables les plus fréquents:
Les effets secondaires les plus fréquents (qui peuvent toucher plus d'une personne sur 10) sont les infections (y compris dans le nez, la gorge et les sinus), les réactions au site d'injection (rougeur, démangeaison, saignement, douleur ou gonflement), les maux de tête et les douleurs musculaires et osseuses.
D'autres effets secondaires graves et rares (pouvant toucher jusqu'à 1 personne sur 1 000) incluent l'incapacité de la moelle osseuse à produire des cellules sanguines, des lésions nerveuses causées par la dégradation de l'enveloppe des fibres nerveuses, le lupus et les affections apparentées au lupus, et le syndrome de Stevens-Johnson.
Contre-indications : Tuberculose active, infections graves (septicémie, infections opportunistes), insuffisance cardiaque
Utilisation chez la femme enceinte : Le CRAT considère qu’il n’y a pas d’association établie entre un effet malformatif particulier et l’exposition concernée (passage des Ig1 transplacentaires après la 14e SA donc après la fin de l'organogénèse). L'adalimumab passe le placenta : à la naissance, les concentrations maternelles néonatales sont supérieures aux concentrations plasmatiques maternelles. Parmi plus de 3000 patientes exposées en 2e partie de grossesse à un anti-TNF alpha (infliximab et adalimumab), dont 1500 au 3e trimestre de grossesse, aucun effet attribuable au traitement n'est retenu (prématurité, infections...) chez les enfants suivis jusque l'âge de 5 ans. Donc on conseille une consultation pré-conceptionnelle pour faire le point sur la pathologie. L'adalimumab peut être poursuivi pendant la grossesse en tenant compte du risque de l'immunosuppression du traitement. La concentration de l'adalimumab dans le lait est très faible, voire indétectable, de même que dans le sang des enfants ayant été allaités par une mère traitée.
Principales références :
- Sandborn WJ et al., Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis, 2012 , Gastroenterology ; 142:257-65
- BeukelmanT et al., American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis, 2011, Arthritis Care Res ; 63:465-82
Liens
- Fiche médicament de l'adalimumab sur le site du GETAID
- Centre de référence sur les agents tératogènes (CRAT) : Adalimumab et grossesse / allaitement
- Lien vers Human medicine European public assessment report (EPAR)
- Fiche de l'Association Nationale de Défense contre l'Arthrite Rhumatoide (ANDAR) : Humira [pdf]
- IMGT/DB
- Avis de la HAS sur l'Imraldi
- Vidal
- Nouvelle formulation d'IMRALDI - vidal
- Base de données des médicaments
- ANSM : médicaments biosimilaires de l'Humira
Document d'aide à la dispensation à l'officine
en cours de finalisation
Remarque :
Dernière mise à jour : janvier 2022
Relecture par : Mathilde GLAZIOU