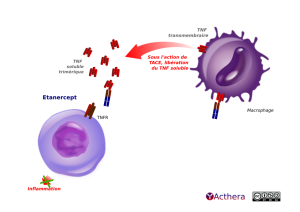
Etanercept (LIFMIOR®) - Biosimilaire
Attention :
L'autorisation de mise sur le marché du LIFMIOR® est devenue caduque parce qu'il n'a pas été commercialisé dans l'Union européenne au cours des trois années qui ont suivi l'octroi de l'autorisation.
Structure : Protéine de fusion comprenant le récepteur p75 du TNF couplé au domaine Fc d'une IgG1 humaine
Code ATC : L04AB01
Cible: TNF (tumor necrosis factor) soluble et membranaire
Mode de production : Produit par génie génétique et exprimé dans des cellules ovariennes de hamster chinois (CHO)
Forme galénique : Poudre à diluer pour injection par perfusion IV
Mode d'administration : IV
Conservation : Ce médicament doit être conservé entre +2 et +8°C (au réfrigérateur). Si nécessaire, il peut être conservé à température ambiante (sans dépasser 25°C) pendant 4 semaines. Passé ce délai, le produit doit être jeté. Le produit ne doit pas être congelé. Après reconstitution, les solutions doivent être utilisées immédiatement, sans jamais dépasser 6h à température ambiante.
Date de la première AMM : EMA février 2017
Laboratoires : Pfizer
Indications :
Lifmior, en association avec le méthotrexate, est indiqué dans le traitement de la polyarthrite rhumatoïde active modérée à sévère chez l'adulte lorsque la réponse aux médicaments antirhumatismaux modificateurs de la maladie, y compris le méthotrexate (sauf contre-indication), est inadéquate.
Lifmior peut être administré en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inappropriée.
Lifmior est également indiqué dans le traitement de la polyarthrite rhumatoïde sévère, active et progressive chez les adultes non traités précédemment par le méthotrexate.
- Arthrite juvénile idiopathique polyarticulaire :
Traitement de la polyarthrite (facteur rhumatoïde positif ou négatif) et de l'oligoarthrite étendue chez l'enfant et l'adolescent à partir de l'âge de 2 ans qui ont eu une réponse inadéquate ou qui se sont ou qui se sont révélés intolérants au méthotrexate.
Traitement du rhumatisme psoriasique chez les adolescents à partir de l'âge de 12 ans qui ont eu une réponse inadéquate à la méthotrexate ou qui se sont avérés intolérants à celle-ci.
Traitement de l'arthrite liée à l'enthésite chez les adolescents à partir de 12 ans qui ont eu une réponse inadéquate ou qui se sont avérés intolérants au méthotrexate.
Traitement du rhumatisme psoriasique actif et progressif chez l'adulte lorsque la réponse à un précédent traitement antirhumatismal modificateur de la maladie a été inadéquate.
Spondylarthrite ankylosante (SA) : Traitement des adultes atteints de spondylarthrite ankylosante active sévère qui n'ont pas répondu de façon adéquate au traitement conventionnel.
Spondyloarthrite axiale non radiographique : Traitement des adultes atteints de spondyloarthrite axiale non radiographique sévère avec des signes objectifs d'inflammation tels qu'indiqués par une élévation du taux de la protéine C-réactive (CRP) et/ou des signes d'imagerie par résonance magnétique (IRM), et qui ont déjà reçu un traitement conventionnel et qui ont eu une réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Traitement des adultes atteints de psoriasis en plaques modéré à sévère qui n'ont pas répondu (ou qui présentent une contre-indication/intolérance) à d'autres traitements systémiques, y compris la ciclosporine, le méthotrexate ou le psoralène et la lumière ultraviolette A (PUVA)
Traitement du psoriasis en plaques sévère chronique chez les enfants et les adolescents à partir de l'âge de 6 ans qui
sont insuffisamment contrôlés par d'autres thérapies systémiques ou photothérapies, ou ne les tolèrent pas. 1er anti-TNF indiqué dans le psoriasis de l'enfant
Usage : Prescription initiale hospitalière annuelle. Médicament d'exception. Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en pédiatrie, en médecine interne ou en dermatologie.
Posologies : La dose recommandée est de 25 mg de Lifmior® administrés deux fois par semaine ou de 50 mg administrés une fois par semaine.
Les données disponibles suggèrent qu'une réponse clinique est généralement obtenue dans les 12 semaines de traitement. Pour le psoriasis, on reste sur la même dose (ci-dessus) mais alternativement, on peut voir 50 mg administrés deux fois par semaine pendant une période allant jusqu'à 12 semaines, suivis, si nécessaire, d'une dose de 25 mg deux fois par semaine ou de 50 mg une fois par semaine.
Mécanisme d'action :
L'etanercept est un dimère du domaine de liaison extracellulaire du TNFR2 (p75) associé au fragment Fc d'une l'IgG1 humaine. C'est un inhibiteur compétitif de la liaison du TNF à ses récepteurs de surface, provoquant un blocage des réponses cellulaires induites et une inhibition du processus inflammatoire. L'etanercept peut neutraliser le TNF libre ou membranaire. Comparativement aux autres anti-TNF, l'etanercept ne provoque pas de lyse des cellules produisant du TNF. Il inhibe également la lymphotoxine α, autre cytokine proinflammatoire.
Effets indésirables les plus fréquents: Infections cutanées, respiratoires, urinaires (cystites).
Contre-indications : hypersensibilité au médicament, septicémie, infections (tuberculose...)
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est d’environ 3 jours, soit une élimination complète en 15 jours environ.
Utilisation chez la femme enceinte : Concernant l'aspect malformatif, les données publiées chez les femmes enceintes exposées à l’étanercept au 1er trimestre de la grossesse sont très nombreuses et rassurante (pas de lien établi par le CRAT entre l'aspect malformatif et l'exposition). Le passage placentaire de l'étanercept est faible. Les concentrations plasmatiques au cordon sont faibles (de l'ordre de 8%). L'étanercept a été poursuivi au 2e et 3e trimestre par 200 patientes : aucun effet attribuable au traitement n'est retenu chez les enfants à la naissance. Donc on conseille une consultation pré-conceptionnelle pour faire le point sur la pathologie. L'étanercept peut être poursuivi pendant la grossesse en tenant compte du risque de l'immunosuppression du traitement. La concentration de l'étanercept dans le lait est très faible. Il est indétectable dans le sang des enfants ayant été allaités par une mère traitée. Compte tenu de sa structure polypeptidique, l’étanercept est probablement détruit dans le tube digestif, ce qui rend peu vraisemblable une exposition systémique de l’enfant via le lait.
Principales références :
- (Strand et al., 2012), (Yokota et al., 2010)
Liens :
- Fiche de l'Association Nationale de Défense contre l'Arthrite Rhumatoide (ANDAR) : ENBREL® [pdf]
- Human medicine European public assessment report (EPAR)
- CRAT
- ANSM : biosimilaires de l'étanercept
Remarque :
Dernière mise à jour : 08/22
Relecture par : Mathilde GLAZIOU