Bevacizumab (ZYRABEV®) - Biosimilaire
Structure : AcM humanisé, IgG1k
Code ATC : L01XC07
Nomenclature Ge : IgG1κ G1e0
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit par la technologie de l'ADN recombinant dans des cellules d'ovaire de Hamster Chinois
Forme galénique : Flacons de 4 ml ou 16 ml contenant respectivement 100 mg et 400 mg de bevacizumab. Chaque ml de solution à diluer contient 25 mg de bevacizumab.
Mode d'administration : IV perfusion de 90 min, pas en bolus
Conservation : Au réfrigérateur pendant 3 ans avant ouverture. La stabilité chimique et physique en cours d’utilisation a été démontrée pendant 30 jours entre 2°C et 8°C puis pendant 48 heures supplémentaires entre 2°C et 30°C dans une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %). Pour éviter toute contamination microbiologique, il est fortement recommandé d'utiliser la solution immédiatement après dilution.
Date de la première AMM : EMA - février 2019
Indications :
- Cancer colorectal métastasique : en association à une chimiothérapie à base de fluoropyrimidine chez les patients adultes (étude AVF2107g).
- Cancer du sein métastasique :
En association au paclitaxel, en première ligne.
En association à la capécitabine, en première ligne.
Non à petites cellules en association à une chimiothérapie à base de sels de platine, dans le traitement de première ligne pour des cancers avancés et non opérables, métastatiques ou en rechute
Non à petites cellules non épidermoïdes, en association à l'erlotinib, en première ligne pour des cancers avancés et non opérables, métastatiques ou en rechutes, et présentant des mutations activatrices de l'EGFR.
- Cancer du rein (avancé et/ou métastatique) : En association à l'interféron alfa-2a, en traitement de première ligne.
- Cancer de l'ovaire avancé, des trompes de Fallope ou péritonéal primitif :
En association au carboplatine et au paclitaxel, en première ligne.
En association au carboplatine et à la gemcitabine en première récidive
En association au paclitaxel, au topotécan ou à la doxorubicine liposomale pégylée en rechute
- Carcinome du col de l'utérus persistant, en rechute ou métastatique :
En association au paclitaxel et au cisplatine
En association au paclitaxel et au topotécan
Usage : réservé à l'usage hospitalier. Prescription réservée aux spécialistes en cancérologie, oncologie médicale.
Posologies :
Cancer colo-rectal : 5 ou 10 mg/kg toutes les 2 semaines ou 7,5 mg/kg ou 15 mg/kg une fois toutes les 3 semaines en IV.
Cancer du sein : 10 mg/kg toutes les 2 semaines ou 15 mg/kg toutes les 3 semaines en IV.
Cancer bronchique : 15 mg/kg toutes les 3 semaines
Cancer du rein : 10 mg/kg toutes les 2 semaines
Cancer de l'ovaire : 10 mg/kg toutes les 2 semaines ou 15 mg/kg toutes les 3 semaines
Cancer du col de l'utérus : 15 mg/kg toutes les 3 semaines
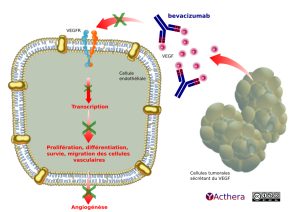
Mécanisme d'action :
Le bevacizumab se lie sélectivement au VEGF humain et neutralise l'activité biologique par inhibition de la liaison du VEGF à ses récepteurs Flt-1 (VEGFR-1) et KDR (VEGFR-2), situé à la surface des cellules endothéliales. Cette neutralisation permet de réduire la vascularisation des tumeurs et de diminuer l'angiogenèse tumorale, inhibant ainsi la croissance tumorale.
Effets indésirables les plus fréquents: neutropénie, leucopénie, thrombopénie, hypertension, asthénie, amaigrissement, troubles digestifs.
Contre-indications : hypersensibilité au médicament, grossesse et allaitement.
Utilisation chez la femme enceinte : CI (et pas de données disponibles sur le CRAT)
Principales références :
Références bibliographiques :
- Assoun S, Brosseau S, Steinmetz C, Gounant V, Zalcman G. Bevacizumab in advanced lung cancer: state of the art. Future Oncol. 2017;13(28):2515‐2535. doi:10.2217/fon-2017-0302
- Keating GM. Bevacizumab: a review of its use in advanced cancer. Drugs. 2014;74(16):1891‐1925. doi:10.1007/s40265-014-0302-9
- Tomasello G, Petrelli F, Ghidini M, Russo A, Passalacqua R, Barni S. FOLFOXIRI Plus Bevacizumab as Conversion Therapy for Patients With Initially Unresectable Metastatic Colorectal Cancer: A Systematic Review and Pooled Analysis. JAMA Oncol. 2017;3(7):e170278. doi:10.1001/jamaoncol.2017.0278
- Rosen LS, Jacobs IA, Burkes RL. Bevacizumab in Colorectal Cancer: Current Role in Treatment and the Potential of Biosimilars. Target Oncol. 2017;12(5):599‐610. doi:10.1007/s11523-017-0518-1
- Chellappan DK, Leng KH, Jia LJ, et al. The role of bevacizumab on tumour angiogenesis and in the management of gynaecological cancers: A review. Biomed Pharmacother. 2018;102:1127‐1144. doi:10.1016/j.biopha.2018.03.061
Remarque :
Dernière mise à jour : 02/23
Par : Mathilde GLAZIOU