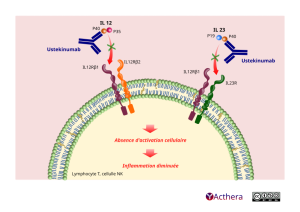
Ustekinumab (STELARA®) - Bioréférent
Structure : AcM humain, IgG1k
Cible : sous unité p40 de l'IL-12 et de l'IL-23
Code ATC : L04AC05
Forme galénique :
- flacon contenant 130 mg d'ustekinumab à diluer dans 26 mL (5 mg/mL).
- solution injectable en seringue préremplie à 45 mg et 90 mg d'ustekinumab (disponible en ville)
- solution injectable en stylo prérempli à 45 mg et 90 mg d'ustekinumab (disponible en ville)
Mode d'administration : IV ou SC
Date de la première AMM : EMA 2009 / FDA 2009
Laboratoire : Janseen Cilag International NV
Conservation : A conserver au réfrigérateur. Les seringues préremplies individuelles peuvent être conservées à température ambiante jusqu'à 30 °C pendant une période unique de 30 jours maximum dans le carton d'origine à l'abri de la lumière. Une fois qu'une seringue a été conservée à température ambiante (jusqu'à 30 °C), elle ne doit pas être remise au réfrigérateur.
Indications :
- Psoriasis en plaques : traitement du psoriasis en plaques modéré à sévère chez l'adulte qui n'a pas répondu, ou qui présente une contre-indication, ou qui est intolérant aux autres traitements systémiques dont la ciclosporine, le méthotrexate (MTX) ou la puvathérapie (psoralène et UVA)
- Psoriasis en plaques de la population pédiatrique : traitement du psoriasis en plaques modéré à sévère chez l'enfant et l'adolescent âgé de 6 ans et plus, en cas de réponse insuffisante ou d'intolérance aux autres traitements systémiques ou aux photothérapies (les stylos n'ont pas cette indication).
- Rhumatisme psoriasique : seul ou en association avec le méthotrexate (MTX), est indiqué dans le traitement du rhumatisme psoriasique actif chez l'adulte lorsque la réponse à un précédent traitement de fond antirhumatismal non-biologique (DMARD) a été inadéquate
- Maladie de Crohn : traitement de la maladie de Crohn active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou par anti-TNFα, ou qui présentent une contre-indication médicale à ces traitements.
- Rectocolite hémorragique : traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou à un agent biologique, ou qui présentent une contre-indication médicale à ces traitements.
Prix indicatif (avril 2024):
2 071,98 € le stylo, la seringue ou le flacon de solution injectable de 45 ou 90 mg,
Usage : Prescription initiale hospitalière annuelle. Prescription réservée aux spécialistes en dermatologie, gastro-entérologie et hépatologie, médecine interne, rhumatologie. Disponible en ville.
Posologies : La dose initiale d'ustekinumab est de 45 mg suivie d'une dose de 45 mg 4 semaines plus tard, puis une dose de 45 mg toutes les 12 semaines
Mécanisme d'action :
Les épisodes inflammatoires observés dans le psoriasis et les MICI sont en partie liés à un trouble de régulation de l'IL-12 et de l'IL-23, deux cytokines pro-inflammatoires. L'ustékinumab, est dirigé contre la sous unité p40 commune à l'IL-12 et à l'IL-23. L'ustékinumab empêche la fixation de ces interleukines au récepteur IL-12Rβ1 présent à la surface des cellules immunitaires, limitant ainsi l'activation des cellules NK, des LT CD4+.
Effets indésirables les plus fréquents : infection dentaire, infection des voies respiratoire
Contre-indications : hypersensibilité au médicament, patient avec infection active
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est longue (3 semaines en moyenne), soit une élimination complète du plasma en 15 semaines environ.
Utilisation chez la femme enceinte : Concernant l'aspect malformatif, les données publiées chez les femmes enceintes exposées à l’ustékinumab au 1er trimestre de la grossesse sont nombreuses et rassurantes. De plus, l’ustékinumab n’est pas tératogène chez le singe. Concernant l'aspect foetal et maternel, il y a un passage transplacentaire de l'ustékinumab à partir de 14 SA. Les données publiées chez les femmes enceintes exposées à l’ustékinumab au 2ème et/ou 3ème trimestres de la grossesse sont peu nombreuses, mais aucun effet fœtal ou néonatal particulier attribuable au traitement n’a été signalé à ce jour. Cependant, le nourrisson peut être exposé à un risque plus important d'infections.
Concernant l'allaitement, aucun événement particulier n’a été rapporté parmi une dizaine d’enfants allaités par des mères sous ustékinumab. C'est une molécule envisageable pendant l'allaitement.
Pharmacovigilance novembre 2022 : Le comité de pharmacovigilance (PRAC) de l'EMA recommande de ne pas administrer de vaccins vivants atténués aux nourrissons jusqu'à 6 mois s'ils ont été exposé à l'ustekinumab in utero (avertissement sur la notice). Cet immunosuppresseur a été détecté dans le sérum d'enfants exposés et le PRAC estime que le risque d'infection peut être plus important chez ces enfants.
Principales références :
Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn's Disease. N Engl J Med. 2016;375(20):1946‐1960. doi:10.1056/NEJMoa1602773
Sands BE, Sandborn WJ, Panaccione R, et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med. 2019;381(13):1201‐1214. doi:10.1056/NEJMoa1900750
Gisbert JP, Chaparro M. Ustekinumab to treat Crohn's disease. Ustekinumab en el tratamiento de la enfermedad de Crohn. Gastroenterol Hepatol. 2017;40(10):688‐698. doi:10.1016/j.gastrohep.2017.08.006
Lamb YN, Duggan ST. Ustekinumab: A Review in Moderate to Severe Crohn's Disease. Drugs. 2017;77(10):1105‐1114. doi:10.1007/s40265-017-0765-6
Jeon C, Sekhon S, Yan D, Afifi L, Nakamura M, Bhutani T. Monoclonal antibodies inhibiting IL-12, -23, and -17 for the treatment of psoriasis. Hum Vaccin Immunother. 2017;13(10):2247‐2259. doi:10.1080/21645515.2017.1356498
Liens :
- fiche médicament de l'ustekinumab sur le site du GETAID
- Avis de la HAS sur Stelara
- Lien vers Human medicine European public assessment report (EPAR)
- Vidal
- CRAT
- IMGT-DB
Remarque :
Dernière mise à jour : 04/24
Par : Mathilde GLAZIOU