Trastuzumab (OGIVRI®) - Biosimilaire
Structure : AcM humanisé, IgG1k
Code ATC : L01XC03
Nomenclature Ge : IgG1κ G1e0
Cible: HER-2 (human epidermal growth factor receptor-2)
Mode de production : Produit par une culture de cellules de mammifère (ovaire de hamster chinois CHO) et purifié par chromatographie d’affinité et d’échange d’ions, comportant des procédés d’inactivation et d’élimination virales spécifiques.
Forme galénique : 150 mg ou 420 mg poudre à diluer pour perfusion
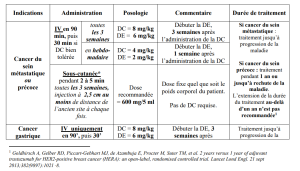
Mode d'administration : IV
Conservation : Avant ouverture, le flacon se conserve 4 ans au réfrigérateur entre 2 et 8°C. Après reconstitution aseptique avec de l’eau pour préparations injectables stérile, la stabilité physicochimique de la solution reconstituée a été démontrée pendant 48 heures entre 2°C et 8°C. Après dilution aseptique dans des poches de chlorure de polyvinyle, de polyéthylène ou de polypropylène contenant une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %), la stabilité physico-chimique de l'Ogivri a été démontrée pendant 30 jours entre 2°C et 8°C, et pendant 24 heures à une température ne dépassant pas 30°C.
Date de la première AMM : FDA 2017 / EMA 2018
Laboratoires : Mylan
Indications : Avant toute administration, il faut s'assurer de la positivité du test Her-2
- Cancer du sein métastatique HER2 positif :
En monothérapie, chez les patients déjà pré-traités par au moins deux protocoles de chimiothérapie pour leur maladie métastatique. Les chimiothérapies précédentes doivent au moins inclure une anthracycline et un taxane, à moins que ces traitements ne conviennent pas aux patients. Les patients répondeurs à l'hormonothérapie doivent également être en échec à l'hormonothérapie, à moins que ces traitements ne leur conviennent pas
En association avec le paclitaxel, chez les patients non pré-traités par chimiothérapie pour leur maladie métastatique et chez lesquels le traitement par anthracyclines ne peut pas être envisagé.
En association avec le docétaxel, chez les patients non pré-traités par chimiothérapie pour leur maladie métastatique.
En association à un inhibiteur de l'aromatase, chez les patientes ménopausées ayant des récepteurs hormonaux positifs, non traitées précédemment par trastuzumab.
- Cancer du sein précoce HER2 positif :
Après chirurgie, chimiothérapie (néoadjuvante ou adjuvante) et radiothérapie (si indiquée) .
Après une chimiothérapie adjuvante avec la doxorubicine et le cyclophosphamide, en association avec le paclitaxel ou le docétaxel.
En association à une chimiothérapie adjuvante associant le docétaxel et le carboplatine.
En association à une chimiothérapie néoadjuvante, suivie d'un traitement adjuvant avec Herceptin, chez les patients ayant une maladie localement avancée (y compris inflammatoire) ou des tumeurs mesurant plus de 2 cm de diamètre.
- Cancer gastrique (adénocarcinome métastatique de l'estomac ou jonction oesogastrique) métastatique HER2 positif : en association à la capécitabine ou au 5-fluoro-uracile et au cisplatine, chez les patients adultes n'ayant pas été précédemment traités pour leur maladie métastatique..
Prix indicatif :
Usage :
- Médicament soumis à prescription hospitalière.
- Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie.
- Médicament nécessitant une surveillance particulière pendant le traitement.
- Première administration à réaliser en milieu hospitalier
Posologie :
Pour une administration toutes les 3 semaines : la dose de charge initiale est de 8 mg/kg de poids corporel suivi de 6 mg/kg de poids corporel toutes les 3 semaines
Pour une administration hebdomadaire, la dose de charge initiale est de 4 mg/kg de poids corporel suivi de 2 mg/kg de poids corporel toutes les semaines.
NB : la dose de charge doit être administrée en perfusion de 90 min. Si elle s'est bien passée, les doses suivantes peuvent être administrées sur des perfusions de 30 min.
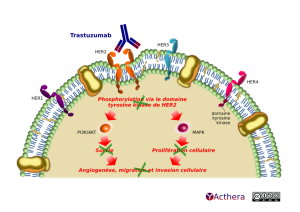
Mécanisme d'action : Lorsque le trastuzumab se fixe à la partie extracellulaire de HER-2 le complexe est internalisé. Cette internalisation le rend inactif, bloque son activité tyrosine kinase par formation d'un dimère ou d'un tétramère de HER-2 et neutralise les cascades de transduction ce qui limite la prolifération des cellules cancéreuses surexprimant HER-2.
Effets indésirables les plus fréquents: Fièvre/frissons/fatigues dans les 24h après la perfusion, douleurs articulaires/musculaires, rhinopharyngite, céphalées, diarrhées, toux, neutropénie, anémie, leucopénie, thrombocytopénie, cystite, infections, perte de poids, anorexie, somnolence, conjonctivite, sécheresse oculaire.
Contre-indications : hypersensibilité au médicament, patient avec infection sévère ou déficit immunitaire, dyspnée de repos sévère en rapport avec des complication liées au stade avancé de la maladie ou oxygénodépendante.
Principales références :
- Slamon et al., 2011,
- Hudis, 2007
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Ogivri (2019)
- Vidal
- IMGT-DB
Remarque :
Dernière mise à jour : 11/22
Par : Mathilde GLAZIOU