Ranibizumab (XIMLUCI®) - Biosimilaire
Structure : fragment Fab issu d'un AcM humanisé, IgG1k
Code ATC : S01LA04
Nomenclature Ge : IgG1κ G1e6
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique : Flacon contenant 2,3 mg de ranibizumab dans 0,23 ml de solution. Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 ml contenant 0,5 mg de ranibizumab aux patients adultes
Mode d'administration : injection intravitréenne
Date de la première AMM : EMA novembre 2022
Laboratoires : STADA Arzneimittel AG
Indications :
- Le traitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l'âge (DMLA).
- Le traitement de la baisse visuelle due à l’oedème maculaire diabétique (OMD).
- Le traitement de la rétinopathie diabétique proliférante (RDP)
- Le traitement de la baisse visuelle due à l’oedème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
- Le traitement de la baisse visuelle due à une néovascularisation choroïdienne (NVC).
Prix indicatif : xxx
Usage : réservé aux spécialistes en ophtalmologie. Médicament d'exception. Depuis l'arrêté du 31/10/24, le ranibizumab fait partie du groupe biologique similaire pouvant donner lieu à une substitution par le pharmacien d'officine.
Posologies : La dose recommandée chez les adultes est de 0,5 mg, administrée en une injection intravitréenne unique de 0,05 ml. L’intervalle entre deux doses injectées dans le même oeil doit être d’au moins quatre semaines. Le traitement chez les adultes sera initié avec une injection par mois jusqu’à ce que l’acuité visuelle maximale soit atteinte et/ou jusqu’à l’absence de signe d’activité de la maladie, c’est-à-dire pas de changement de l’acuité visuelle ni des autres signes et symptômes de la maladie sous traitement continu.
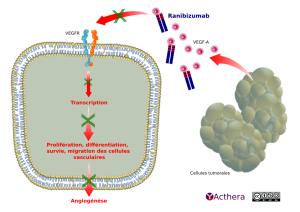
Mécanisme d'action :
La liaison du VEGF-A à ses récepteurs induit une prolifération et une néovascularisation des cellules endothéliales ainsi qu'une perméabilité vasculaire, favorisant la progression de la DMLA ou la baisse de vision due, soit à un œdème maculaire diabétique, soit à un œdème maculaire secondaire à une occlusion des veines rétiniennes. Le ranibizumab est un fragment d'anticorps monoclonal humanisé dirigé contre le VEGF-A qui empêche la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2.
Effets indésirables les plus fréquents : céphalées, rhinopharyngite, infections des voies urinaires, anémies, affections hématologiques et lymphatiques, EI liés à la procédure d'injection intra-vitréenne (hyalite, décollement du vitré, hémorragies rétinienne...), arthralgies.
Contre-indications : Hypersensibilité au médicament, patient avec infection ou inflammation oculaire.
Utilisation chez la femme enceinte : Selon le CRAT, les données publiées chez les femmes enceintes exposées au ranibizumab en cours de grossesse sont très peu nombreuses, mais aucun effet malformatif, foetotoxique ou néonatal n’a été signalé à ce jour. Le ranibizumab n'est pas non plus tératogène chez le singe. Le passage placentaire parait négligeable car les immunoglobulines passent le placenta en utilisant un récepteur fixant leur fragment Fc et le ranibizumab en est dépourvu.
Principales références :
- Nguyen et al., 2012 ; Bandello et al., 2011
Liens
- Human medicine European public assessment report (EPAR)
- Lien vers la fiche info de la base de données publique des médicaments
- FDA : pas de données au 27/03/23
- ANSM
- Meddispar : pas de données au 27/03/23
- CRAT
- Vidal : pas de données au 27/03/23
- IMGT/DB
- HeTop
Remarque :
Dernière mise à jour : 12/24
Par : Mathilde GLAZIOU