Ranibizumab (RIMMYRAH®) - Biosimilaire
Attention :
Fiche en cours de rédaction
Autre nom : xxx
Structure : fragment Fab d'IgG1 - kappa humanisé
Code ATC : S01LA04
Nomenclature Ge : IgG1κ G1e6
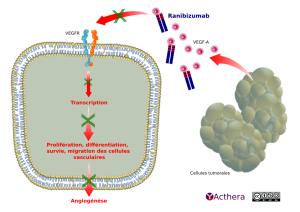
Cible: VEGF(vascular endothelial growth factor)
Mode de production : produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique : Solution injectable (flacon de 0,23 ml)
Mode d'administration : injection intravitréenne
Date de la première AMM : FDA XXX / EMA janvier 2024
Laboratoires et lien vers xxx: QILU PHARMA SPAIN S.L
Indications :
- Dégénérescence maculaire liée à l'âge (DMLA)
- Néovascularisation choroïdienne (NVC)
diabétique (OMD)
secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
- Rétinopathie diabétique proliférante (RDP)
- Chez les prématurés, dans le traitement de la rétinopathie du prématuré (RP)
Prix indicatif (année) : XXX
Usage : Prescription réservée aux spécialistes en ophtalmologie. Médicament d'exception, disponible en ville. Depuis l'arrêté du 31/10/24, le ranibizumab fait partie du groupe biologique similaire pouvant donner lieu à une substitution par le pharmacien d'officine.
Posologies :
- Chez l'adulte ; 0,5 mg/mois (soit 0,05 mL) en injection intravitréenne, poursuivi jusqu'à ce que l'acuité visuelle soit maximale.
Mécanisme d'action :
La liaison du VEGF-A à ses récepteurs induit une prolifération et une néovascularisation des cellules endothéliales ainsi qu'une perméabilité vasculaire, favorisant la progression de la DMLA ou la baisse de vision due, soit à un œdème maculaire diabétique, soit à un œdème maculaire secondaire à une occlusion des veines rétiniennes. Le ranibizumab est un fragment d'anticorps monoclonal humanisé dirigé contre le VEGF-A qui empêche la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2.
Effets indésirables les plus fréquents : La majorité des effets indésirables rapportés après l’administration de ranibizumab sont liés à la procédure d’injection intravitréenne.
- Les effets indésirables oculaires les plus fréquemment rapportés après l’injection de ranibizumab sont : des douleurs oculaires, des hyperhémies oculaires, des augmentations de la pression intraoculaire, des hyalites, des décollements du vitré, des hémorragies rétiniennes, des troubles visuels, des corps flottants vitréens, des hémorragies conjonctivales, des irritations oculaires, des sensations de corps étranger dans l’oeil, des sécrétions lacrymales accrues, des blépharites, des sécheresses oculaires et des prurits oculaires.
- Les effets indésirables non oculaires les plus fréquemment rapportés sont des céphalées, des rhino-pharyngites et des arthralgies.
Contre-indications : Hypersensibilité au médicament, patient avec infection ou inflammation oculaire.
Principales références :
- Nguyen et al., 2012 ; Bandello et al., 2011
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
- IMGT/mAb-DB
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour :
Relecture par :