Aflibercept (OPUVIZ®) - Biosimilaire
Autre nom : aflibercept-yszy
Structure : Protéine de fusion recombinante correspondant aux domaines extracellulaires des VEGFR humains 1 et 2 fusionnés au fragment Fc d'une IgG1 humaine.
Code ATC : S01LA05
Nomenclature Ge : xxx
Cible: VEGF-A (vascular endothelial growth factor), VEGF-B
Mode de production : Produit dans des cellules ovariennes K1 de hamster chinois (CHO) par la technique de l’ADN recombinant
Forme galénique : Solution injectable en seringue pré-remplie à 40 mg/mL. Un flacon contient un volume extractible d’au moins 0,1 mL, équivalant à au moins 4 mg d’aflibercept. Ceci fournit la quantité nécessaire de produit pour délivrer une seule dose de 0,05 mL contenant 2 mg d’aflibercept
Mode d'administration : Injection intravitréenne
Date de la première AMM : FDA mai 2024 / EMA novembre 2024
Laboratoires : Samsung Bioepis NL B.V.
Indications :
Forme humide de la dégénérescence maculaire liée à l'âge (DMLA)
Oedème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
Oedème maculaire diabétique (OMD)
Prix indicatif (année) : XXX
Usage : administré uniquement par des médecins qualifiés, expérimentés dans l’administration d’injections intravitréennes
Posologies :
Forme humide de la DMLA
La dose recommandée d’Opuviz est de 2 mg d’aflibercept, correspondant à 0,05 mL. À l’instauration du traitement, Opuviz est injecté une fois par mois pendant 3 mois consécutifs. L’intervalle entre deux injections est ensuite étendu à deux mois. En fonction du jugement du médecin sur les résultats visuels et/ou anatomiques, l’intervalle entre deux injections peut être maintenu à deux mois ou davantage étendu en utilisant un protocole « Treat and Extend » au cours duquel les intervalles entre les injections augmentent par ajustements de 2 ou 4 semaines afin de maintenir la réponse visuelle et/ou anatomique.
Œdème maculaire secondaire à une occlusion veineuse rétinienne (OVCR ou OBVR)
La dose recommandée d’Opuviz est de 2 mg d’aflibercept, correspondant à 0,05 mL. Après la première injection, le traitement est administré mensuellement. L’intervalle entre deux injections ne doit pas être inférieur à un mois. Si les paramètres visuels et anatomiques indiquent que la poursuite du traitement n’apporte pas de bénéfice au patient, le traitement par Opuviz doit être arrêté. Le traitement mensuel est poursuivi jusqu’à ce que l’acuité visuelle maximale soit atteinte et/ou jusqu’à l’absence de signe d’activité de la maladie. Trois injections mensuelles ou plus peuvent être nécessaires. Ensuite, le traitement peut être poursuivi selon un protocole « Treat and Extend » avec une augmentation progressive de l’intervalle entre deux injections afin de maintenir la réponse visuelle et/ou anatomique.
Œdème maculaire diabétique
La dose recommandée d’Opuviz est de 2 mg d’aflibercept, correspondant à 0,05 mL. À l’instauration du traitement, Opuviz est injecté une fois par mois pendant 5 mois consécutifs suivi d’une injection tous les 2 mois. En fonction du jugement du médecin sur les résultats visuels et/ou anatomiques, l’intervalle entre deux injections peut être maintenu à 2 mois ou individualisé, par exemple avec un protocole « Treat and Extend » au cours duquel les intervalles entre les injections augmentent généralement par ajustement 4 de 2 semaines afin de maintenir la réponse visuelle et/ou anatomique. Les données sont limitées pour les traitements avec des intervalles supérieurs à 4 mois. En cas de détérioration des paramètres visuels et/ou anatomiques, l’intervalle entre deux injections doit être réduit en conséquence.
Néovascularisation choroïdienne myopique
La dose recommandée d’Opuviz est d’une injection intravitréenne unique de 2 mg d’aflibercept, correspondant à 0,05 mL. Des injections supplémentaires peuvent être administrées si les paramètres visuels et/ou anatomiques indiquent que la maladie persiste. Les récidives doivent être traitées comme des nouvelles manifestations de la maladie.
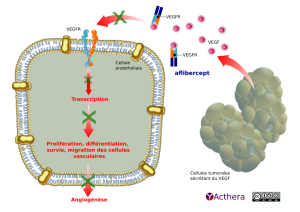
Mécanisme d'action :
Le facteur de croissance de l’endothélium vasculaire de type A (VEGF-A) et le facteur de croissance placentaire (PlGF) appartiennent à la famille des facteurs angiogéniques de type VEGF qui agissent comme de puissants facteurs mitogènes et chimiotactiques et favorisent la perméabilité vasculaire des cellules endothéliales. Le VEGF agit par l’intermédiaire de deux récepteurs tyrosine kinase, le VEGFR-1 et le VEGFR-2, présents sur la surface des cellules endothéliales. Le PlGF se lie uniquement au VEGFR-1, qui est aussi présent sur la surface des leucocytes. L’activation excessive de ces récepteurs par le VEGF-A peut entraîner une néovascularisation pathologique et une perméabilité vasculaire excessive. Le PlGF peut agir en synergie avec le VEGF-A dans ces processus et est aussi connu pour favoriser l’infiltration leucocytaire et l’inflammation vasculaire.
L'aflibercept est une protéine de fusion composée des domaines extracellulaires des récepteurs VEGFR-A et B. Cette protéine est capable de se lier au VEGF-A, B et PlGF A et B. Cette liaison permet l'inhibition de la croissance et de la prolifération cellulaire par blocage de l'interaction de ces ligands angiogéniques avec leurs récepteurs présents à la surface des cellules endothéliales. L’aflibercept agit comme un récepteur soluble leurre, qui se lie au VEGF-A et au PlGF avec une affinité supérieure à celle de leurs récepteurs naturels et peut ainsi inhiber la liaison et l’activation de ces récepteurs apparentés.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquemment observés (chez au moins 5 % des patients traités par l’aflibercept) étaient l’hémorragie conjonctivale (25 %), l’hémorragie rétinienne (11 %), la baisse de l’acuité visuelle (11 %), la douleur oculaire (10 %), la cataracte (8 %), l’augmentation de la pression intraoculaire (8 %), le décollement du vitré (7 %) et les corps flottants vitréens (7 %).
Contre-indications : hypersensibilité au médicament, patient avec infection ou inflammation oculaire.
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments : pas de données au 30 décembre 2024
- ANSM
- Meddispar
- Vidal : pas de données sur OPUVIZ au 30 décembre 2024
- Centre de référence sur les agents tératogènes (CRAT)