Bevacizumab (LYTENAVA®)
Attention :
Fiche en cours de rédaction
Autre nom : bevacizumab-vikg
Structure : AcM humanisé, IgG1k
Code ATC : S01LA08
Nomenclature Ge : IgG1κ G1e0
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit par la technologie de l'ADN recombinant dans des cellules d'ovaire de Hamster Chinois
Forme galénique : Flacons de 0,3 ml contenant 25mg de bevacizumab.
Mode d'administration : Injection intravitréenne (IVT)
Date de la première AMM : FDA XXX / EMA mai 2024
Laboratoire : Outlook Therapeutics Limited
Indications : Dégénérescence maculaire liée à l'âge (DMLA)
Prix indicatif (année) : XXX
Usage : xxx
Posologies : La dose recommandée est de 1,25 mg administrée par injection intravitréenne toutes les quatre semaines (une fois par mois). Cela correspond à un volume d’injection de 0,05 ml.
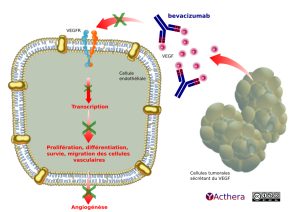
Mécanisme d'action :
Le bevacizumab se lie sélectivement au VEGF humain et neutralise l'activité biologique par inhibition de la liaison du VEGF à ses récepteurs Flt-1 (VEGFR-1) et KDR (VEGFR-2), situé à la surface des cellules endothéliales. Cette neutralisation permet de réduire la vascularisation des tumeurs et de diminuer l'angiogenèse tumorale, inhibant ainsi la croissance tumorale.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquemment rapportés étaient les suivants: hémorragie conjonctivale (5,0 %), corps flottants vitréens (1,5 %), douleur oculaire (1,2 %) et augmentation de la pression intraoculaire (1,2 %). Les effets indésirables moins fréquemment rapportés, mais plus graves, étaient les suivants: augmentation de la pression intraoculaire (0,6 %), cécité transitoire (0,3 %), endophtalmie (0,3 %), inflammation intraoculaire (0,3 %).
Contre-indications :
-Hypersensibilité à la substance active ou à l’un des excipients
-Patients présentant une infection oculaire ou périoculaire active ou suspectée.
-Patients présentant une inflammation intraoculaire active sévère.
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour :
Relecture par :