Ravulizumab (Ultomiris®)
Autres noms : -
Structure : Ac monoclonal humanisé de type IgG2/4k
Code ATC : L04AA43
Nomenclature Ge : IgG2/4κ G4e5
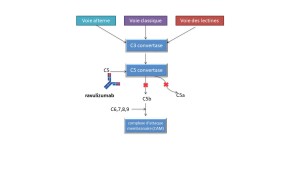
Cible: protéine C5 du complément
Mode de production : produit en culture de cellules d’ovaire de hamster chinois (CHO) par la technologie de l’ADN recombinant
Mode d'administration : IV
Forme galénique : 300 mg/3mL, 300mg/30 mL ou 1100 mg/11 mL, solution de à diluer pour perfusion (flacons). Après dilution, la concentration finale de la solution à perfuser est de 5 ou 50 mg/mL
Conservation :
18 mois pour le 300mg/3mL et 1100 mg/11 mL - 30 mois pour le 300 mg/30 mL
Après dilution du 300 mg/3 mL et du 1100/11 mL, le médicament doit être utilisé immédiatement. Toutefois, la stabilité physico-chimique du produit dilué a été démontrée pendant une durée allant jusqu’à 24 heures à une température comprise entre 2 °C et 8 °C et jusqu’à 4 heures à température ambiante
Après dilution du 300/30 mL, le médicament doit être utilisé immédiatement. Toutefois, la stabilité physico-chimique du produit dilué a été démontrée pendant une durée allant jusqu’à 24 heures à une température comprise entre 2 °C et 8 °C et jusqu’à 6 heures à température ambiante.
Date de la première AMM : FDA 2018 / EMA juillet 2019
Laboratoires : Alexion Europe SAS
Indications :
- Traitement de l'hémoglobinurie paroxystique nocturne (HPN) chez les patients adultes et les patients pédiatriques de plus de 10 kg
qui présentent une hémolyse avec un ou des symptôme(s) clinique(s) indiquant une forte activité de la maladie
qui sont stables sur le plan clinique après un traitement par l'eculizumab pendant au moins les 6 derniers mois
- Traitement du Syndrome hémolytique et urémique (SHU) atypique : chez les patients adultes et chez les patients pédiatriques pesant 10 kg ou plus, naïfs d’inhibiteur du complément ou ayant reçu un traitement par l’eculizumab pendant au moins 3 mois et présentant des signes de réponse à l’eculizumab
- Traitement des myasthénies acquises généralisées : en association au traitement standard chez les patients adultes présentant des anticorps anti-récepteurs de l’acétylcholine (aRAch)
- Traitement des troubles du spectre de la neuromyélite optique : chez les patients adultes présentant des anticorps anti-aquaporine 4 (AQP4).
Prix indicatif (2022) : 4287,88 euros pour un flacon de 300 mg/30mL
Usage : Prescription réservée aux spécialistes et services d'hématologie, de médecine interne, de néphrologie, de pédiatrie.
Médicament réservé à l'usage hospitalier.
Posologies : Chez les patients adultes (≥ 18 ans), les doses d’entretien doivent être administrées une fois toutes les 8 semaines, en commençant deux semaines après l’administration de la dose de charge. La première dose d'entretien est donc administrée 2 semaines après la dose de charge. La dose est calculée en fonction du poids :
Entre 40 kg inclus et 60 kg exclus : dose de charge à 2400 mg et dose d'entretien à 3000 mg
Entre 60 kg inclus et 100 exclus : dose de charge à 2700 mg et dose d'entretien à 3300 mg
Supérieur ou égal à 100 kg : dose de charge à 3000 mg et dose d'entretien à 3600 mg
Pour la population pédiatrique dont le poids est supérieur ou égal à 40kg, la dose est la dose adulte.
Pour la population pédiatrique, dont le poids est strictement inférieur à 40kg :
Entre 10 kg inclus et 20 kg exclus : 600 mg en dose de charge et 600 mg en dose d'entretien (toutes les 4 semaines et non toutes les 8 semaines)
Entre 20 kg inclus et 30 kg exclus : 900 mg en dose de charge et 2100 mg en dose d'entretien
Entre 30 kg inclus et 40 kg exclus : 1200 mg en dose de charge et 2700 mg en dose d'entretien
Pour plus de précisions, se rapporter aux RCP
Mécanisme d'action :
Le ravulizumab se lie sélectivement à la protéine C5 du complément, ce qui inhibe son clivage en C5a (l'anaphylatoxine pro-inflammatoire) et C5b (la sous-unité d'initiation du complexe terminal du complément [C5b-9]) et empêche la génération du complexe C5b-9. Le ravulizumab préserve les composants précoces de l'activation du complément qui sont essentiels à l'opsonisation des microorganismes et à l'élimination des complexes immuns.
Effets indésirables les plus fréquents : Fréquemment des céphalées, troubles digestifs, rhinopharyngites, pyrexie et fatigue. Du fait de son mécanisme d’action, l’utilisation du ravulizumab augmente la prédisposition du patient à une infection/une septicémie à méningocoque (Neisseria meningitidis). Cet EI est peu fréquent.
Contre-indications : Hypersensibilité à la substance, patients présentant une infection par Neisseria meningitidis non résolue lors de l’instauration du traitement ou sans vaccination à jour contre Neisseria meningitidis à moins qu’ils ne reçoivent une antibioprophylaxie appropriée jusqu’à 2 semaines après vaccination.
Utilisation chez la femme enceinte : Selon les RCP, les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement et jusqu’à 8 mois après l’arrêt du traitement. Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction
Principales références :
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Ultomiris
- IMGT/DB
- Site de la FDA
- Base de donnée publique des médicaments
- ANSM
- Meddispar : pas de données au 28/09/23
- CRAT : pas de données au 28/09/23
- Vidal
- HeTop
Dernière mise à jour : Septembre 2023
Par : Mathilde Glaziou