Pertuzumab-trastuzumab (PHESGO®)
• Structure : Combinaison de deux IgG1 humanisés
• Code ATC : L01XY
• Cible: HER-2 (human epidermal growth factor receptor-2)
• Mode de production : produits sur culture de cellules d'ovaire de hamster chinois (cellules CHO)
• Forme galénique :
- Flacon de 10 mL contenant 600 mg de pertuzumab et 600 mg de trastuzumab (chaque mL de solution contient 60 mg de pertuzumab et 60 mg de trastuzumab)
- Flacon de 15 mL contenant 1200 mg de pertuzumab et 600 mg de trastuzumab (chaque mL de solution contient 80 mg de pertuzumab et 40 mg de trastuzumab)
Chaque solution contient du vorhyaluronidase alfa, une enzyme utilisée pour augmenter la dispersion et l’absorption des médicaments co-administrés lors de l'administration par voie sous-cutanée
• Mode d'administration : SC
• Date de la première AMM : FDA XXX / EMA Décembre 2020
• Laboratoire : Roche
• Indications :
Cancer du sein précoce :
en association à une chimiothérapie, dans :
• le traitement néoadjuvant de patients adultes atteints d’un cancer du sein HER2 positif localement avancé, inflammatoire ou à un stade précoce avec un risque élevé de récidive
• le traitement adjuvant de patients adultes atteints d’un cancer du sein précoce HER2 positif avec un risque élevé de récidive
Cancer du sein métastatique :
en association au docétaxel, dans le traitement de patients adultes atteints d’un cancer du sein métastatique ou localement récidivant non résécable HER2 positif, n’ayant pas reçu au préalable de traitement anti-HER2 ou de chimiothérapie pour leur maladie métastatique
• Prix indicatif (2022) : 3143,66 euros le flacon de 600 mg de pertuzumab et 600 mg de trastuzumab ; 5663,49 euros le flacon de 1200 mg de pertuzumab et 600 mg de trastuzumab
• Usage : Médicament réservé à l’usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie.
• Posologies :
Dose de charge : 1200 mg de pertuzumab / 600 mg de trastuzumab (injection SC de 8 min, période d'observation 30 min)
Dose d’entretien (toutes les 3 semaines) : 600 mg de pertuzumab / 600 mg de trastuzumab (injection SC de 5 min, période d'observation 15 min)
En France , l'association à dose fixe par voie SC est réservée à l'usage hospitalier
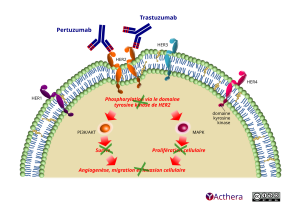
• Mécanisme d'action :
Le pertuzumab et le trastuzumab ciblent le récepteur 2 du facteur de croissance épidermique humain (HER2). Les deux substances se lient à des sous-domaines de HER2 distincts sans entrer en compétition et elles ont des mécanismes complémentaires d’inhibition de la signalisation HER2 :
• Le pertuzumab cible spécifiquement le domaine de dimérisation extracellulaire (sous-domaine II) de HER2 et, ainsi, bloque l’hétérodimérisation ligand-dépendante de HER2 avec d’autres récepteurs de la famille des HER, dont epidermal growth factor receptor (EGFR), HER3 et HER4. En conséquence, le pertuzumab inhibe l’activation des voies de signalisation intracellulaire ligand-dépendantes par deux voies majeures d’activation, la voie mitogen-activated-protein kinase MAP et la voie phosphoinositide 3-kinase PI3K. L’inhibition de ces voies d’activation conduit respectivement à un arrêt de la prolifération cellulaire et à une apoptose.
• Le trastuzumab se lie au sous-domaine IV du domaine extracellulaire de la protéine HER2 pour inhiber les signaux de prolifération et de survie médiés par HER2 indépendamment d’un ligand dans les cellules tumorales humaines qui surexpriment HER2.
De plus, les deux substances sont des médiateurs de la cytotoxicité cellulaire anticorps-dépendante (ADCC). In vitro, il a été établi que l’ADCC du pertuzumab et celle du trastuzumab s’exercent préférentiellement sur les cellules cancéreuses surexprimant HER2, comparé aux cellules qui ne présentent pas cette surexpression.
Effets indésirables les plus fréquents : (>= 30%) alopécie, diarrhée, nausée, anémie, asthénie, et arthralgie. Les événements indésirables graves les plus fréquents (≥ 1 %) rapportés étaient : neutropénie fébrile, insuffisance cardiaque, fièvre, neutropénie, septicémie neutropénique, diminution du nombre de neutrophiles et pneumonie.
Contre-indications : Hypersensibilité aux substances actives ou à l’un des excipients. Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par Phesgo et pendant 7 mois après la dernière dose
Principales références :
- Publications :
Tan AR, Im SA, Mattar A, Colomer R, Stroyakovskii D, Nowecki Z, De Laurentiis M, Pierga JY, Jung KH, Schem C, Hogea A, Badovinac Crnjevic T, Heeson S, Shivhare M, Kirschbrown WP, Restuccia E, Jackisch C; FeDeriCa study group. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer (FeDeriCa): a randomised, open-label, multicentre, non-inferiority, phase 3 study. Lancet Oncol. 2021 Jan;22(1):85-97. doi: 10.1016/S1470-2045(20)30536-2. Epub 2020 Dec 21. Erratum in: Lancet Oncol. 2021 Feb;22(2):e42. PMID: 33357420.
Miles D, Ciruelos E, Schneeweiss A, Puglisi F, Peretz-Yablonski T, Campone M, Bondarenko I, Nowecki Z, Errihani H, Paluch-Shimon S, Wardley A, Merot JL, Trask P, du Toit Y, Pena-Murillo C, Revelant V, Klingbiel D, Bachelot T; PERUSE investigators. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication. Ann Oncol. 2021 Jul 2:S0923-7534(21)02105-0. doi: 10.1016/j.annonc.2021.06.024. Epub ahead of print. PMID: 34224826.
Richard S, Selle F, Lotz JP, Khalil A, Gligorov J, Soares DG. Pertuzumab and trastuzumab: the rationale way to synergy. An Acad Bras Cienc. 2016;88 Suppl 1:565-77. doi: 10.1590/0001-3765201620150178. PMID: 27275646.
Liens
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur PHESGO
- Base de données publique des médicaments
PHESGO 1200 mg/600 mg, solution injectable
PHESGO 600 mg/600 mg, solution injectable
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
- IMGT/mAb-DB
Remarque :
Dernière mise à jour : 12/08/21
Relecture par : Pr C. Carnoy