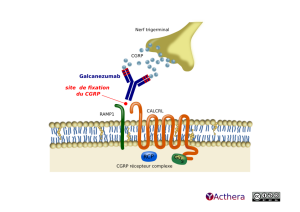
Galcanezumab (EMGALITY®)
Autres nom : galcanezumab-gnlm
Structure : IgG4 humanisé
Code ATC : N02CD02
Nomenclature Ge : IgG4κ G4e3
Cible: Peptide relié au gène de la calcitonine (CGRP)
Forme galénique : stylo ou seringue pré-rempli contenant 120 mg de galcanézumab dans 1 mL de solution
Mode d'administration : SC
Date de la première AMM : EMA novembre 2018 / FDA septembre 2018
Laboratoire : Eli Lilly Nederland B.V.
Indications : prophylaxie de la migraine chez l'adulte ayant au moins 4 jours de migraine par mois
Prix indicatif : XXX
Usage : Prescription réservée aux spécialistes en neurologie
Posologies : 120 mg de galcanézumab en injection sous-cutanée une fois par mois, avec une dose de charge de 240 mg à l'initiation
Mécanisme d'action :
Le galcanézumab se lie au peptide relié au gène de la calcitonine (CGRP) et empêche ainsi son activité biologique. Des concentrations sanguines élevées de CGRP ont été associées à la crise de migraine. Le galcanézumab se lie au CGRP avec une forte affinité (KD = 31 pM) et avec une spécificité élevée (> 10 000 fois vs peptides apparentés tels que l'adrénomédulline, l'amyline, la calcitonine et l'intermédine).
Le récepteur au CGRP est composé de 2 protéines membranaires (hétérodimère), la protéine calcitonin receptor- like receptor (CALCRL) avec 7 domaines transmembranaires, la protéine receptor activity modifying protein 1 (RAMP1) et de 2 protéines cytoplasmiques (receptor coupling protein (RCP) et l' α- subunit of the GS protein (GαS)).
Effets indésirables les plus fréquents: Les effets indésirables reportés pour les doses de 120 et 240 mg au cours des études cliniques sur la migraine ont été : douleur au site d'injection (10,1 %/11,6 %), réactions au site d'injection (9,9 %/14,5 %), vertiges (0,7 %/1,2 %), constipation (1,0 %/1,5 %), prurit (0,7 %/1,2 %) et urticaire (0,3 %/0,1 %). La plupart des effets étaient d'intensité légère ou modérée. Moins de 2,5 % des patients inclus dans ces études ont arrêté en raison d'effets indésirables
Contre-indications :
Principales références :
- Lamb YN. Galcanezumab: First Global Approval. Drugs. 2018;78(16):1769–1775. doi:10.1007/s40265-018-1002-7
- Detke HC, Goadsby PJ, Wang S, Friedman DI, Selzler KJ, Aurora SK. Galcanezumab in chronic migraine: The randomized, double-blind, placebo-controlled REGAIN study. Neurology. 2018 Dec 11;91(24):e2211-e2221. doi: 10.1212/WNL.0000000000006640.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM (pas disponible au 1er juin 2022)
- Meddispar (pas disponible au 1er juin 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 1er juin 2022)
Remarque :
Dernière mise à jour : 1er juin 2022
Relecture par : Pr C. Carnoy