Nirsevimab (BEYFORTUS®)
Autre nom : nirsevimab-alip
Structure : AcM IgG1 kappa humain
Code ATC : J06BD08
Nomenclature Ge : IgG1κ G1e19
Cible: protéine F du virus respiratoire syncytial (VRS)
Mode de production : Produit dans des cellules d’ovaires de hamster chinois (CHO) par la technologie de l’ADN recombinant
Conservation : Au réfrigérateur entre 2 et 8°C. Beyfortus peut être conservé à température ambiante (20 °C - 25 °C) à l'abri de la lumière pendant 8 heures au maximum. Une fois ce délai écoulé, la seringue doit être jetée. A conserver à l'abri de la lumière
Forme galénique : 50 ou 100 mg en seringue préremplie
Mode d'administration : IM sur la face antéro-latérale de la cuisse. Administration par médecins, infirmiers ou sages-femmes
Date de la première AMM : EMA octobre 2022 / FDA juillet 2023
Laboratoires : AstraZeneca AB / Sanofi Pasteur Europe
Indications :
Prévention des infections des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS) chez les nouveau-nés et les nourrissons au cours de leur première saison de circulation du VRS.
Prix public TTC (2023) : 3.57 € (seringues 50 mg et 100 mg)
Usage : Liste 1, sur prescription médicale. Disponible dès le 16 septembre 2023 à l'officine.
Posologies :
La dose recommandée est une dose unique de 50 mg administrée par voie intramusculaire pour les nourrissons dont le poids est <5 kg et une dose unique de 100 mg administré par voie intramusculaire pour les nourrissons dont le poids est ≥5 kg. Beyfortus doit être administré avant le début de la saison d’épidémie à VRS, ou dès la naissance chez les nourrissons nés au cours de la saison d’épidémie à VRS.
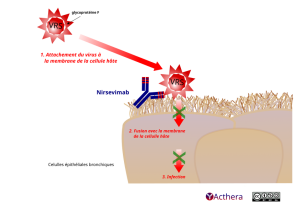
Mécanisme d'action :
Le nirsévimab est un anticorps monoclonal humain recombinant neutralisant à action prolongée de type IgG1ĸ dirigé contre la protéine F du VRS en conformation pré-fusion, qui a été modifié par une triple substitution d’acides aminés (YTE) dans la région Fc pour prolonger la demi-vie sérique. Le nirsévimab se lie à un épitope bien conservé du site antigénique Ø sur la protéine de pré-fusion avec des constantes de dissociation KD = 0,12 nM et KD = 1,22 nM respectivement pour les sous-types A et B du VRS. Le nirsévimab inhibe l’étape essentielle de fusion membranaire dans le processus de pénétration virale, en neutralisant le virus et en bloquant la fusion cellule-cellule.
Effets indésirables les plus fréquents : Eruptions cutanées, pyrexie (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active
Principales références :
- Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, Muller WJ, Zar HJ, Brooks D, Grenham A, Wählby Hamrén U, Mankad VS, Ren P, Takas T, Abram ME, Leach A, Griffin MP, Villafana T; MELODY Study Group. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022 Mar 3;386(9):837-846. doi: 10.1056/NEJMoa2110275. PMID: 35235726.
- Domachowske J, Madhi SA, Simões EAF, Atanasova V, Cabañas F, Furuno K, Garcia-Garcia ML, Grantina I, Nguyen KA, Brooks D, Chang Y, Leach A, Takas T, Yuan Y, Griffin MP, Mankad VS, Villafana T; MEDLEY Study Group. Safety of Nirsevimab for RSV in Infants with Heart or Lung Disease or Prematurity. N Engl J Med. 2022 Mar 3;386(9):892-894. doi: 10.1056/NEJMc2112186. PMID: 35235733.
- Griffin MP, Yuan Y, Takas T, Domachowske JB, Madhi SA, Manzoni P, Simões EAF, Esser MT, Khan AA, Dubovsky F, Villafana T, DeVincenzo JP; Nirsevimab Study Group. Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants. N Engl J Med. 2020 Jul 30;383(5):415-425. doi: 10.1056/NEJMoa1913556. Erratum in: N Engl J Med. 2020 Aug 13;383(7):698. PMID: 32726528.
- Keam SJ. Nirsevimab: First Approval. Drugs. 2023 Feb;83(2):181-187. doi: 10.1007/s40265-022-01829-6. PMID: 36577878.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments : forme 50 mg ou 100 mg
- ANSM
- Disponibilité à l'officine : publication de l'ordre des pharmaciens
- Meddispar : pas de données au 11 novembre 2023
- Centre de référence sur les agents tératogènes (CRAT) : pas de données au 28 août 2023
Remarque :
Dernière mise à jour : 30 septembre 2023
Relecture par : Mathilde Glaziou & Christophe Carnoy