Ibalizumab (TROGARZO®)
Attention :
Le 1er janvier 2023, la Commission européenne a retiré l'autorisation de mise sur le marché de Trogarzo (ibalizumab) dans l'Union européenne. Le retrait a été effectué à la demande du titulaire de l'autorisation de mise sur le marché, Theratechnologies Europe Limited, qui a notifié à la Commission européenne sa décision d'arrêter définitivement la commercialisation du Trogarzo (ibalizumab) dans l'Union européenne, pour des raisons commerciales.
Structure : IgG4 humanisée
Code ATC : J05AX23
Nomenclature Ge : IgG4κ G4e0
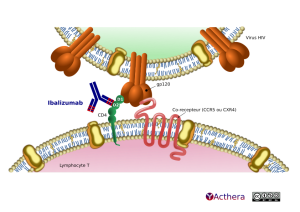
Cible: Domaine 2 du CD4
Mode de production : production dans des cellules de myélome murin non sécrétantes (NS0) par la technologie de l'ADN recombinant.
Mode d'administration : IV
Forme galénique : Un flacon contient 200 mg d'ibalizumab dans 1,33 ml de solution (excipients : le saccharose, le chlorure de sodium, le polysorbate 80, l'histidine, l'acide chlorhydrique, l'eau pour préparations injectables)
Date de la première AMM : EMA sept 2019 / FDA mars 2018
Laboratoires et lien vers TROGARZO : Theratechnologies Inc. et TaiMed Biologics, Inc.
Indications : En association avec d'autres médicaments antirétroviraux, dans le traitement des adultes infectés par le VIH-1 multirésistant chez lesquels il est autrement impossible d'établir un schéma de traitement antirétroviral suppressif. Etude de phase III : TMB-301 (NCT02475629)
Prix indicatif : XXX
Usage : hospitalier
Posologies : dose de charge unique de 2 000 mg suivie d'une dose d'entretien de 800 mg toutes les deux semaines en combinaison avec d'autres traitements
Mécanisme d'action : Inhibiteur post-attachement, bloquant la fixation du VIH au CCR5 et CXCR4.
L'ibalizumab empêche le VIH-1 d'infecter les lymphocytes T CD4+ en se liant au domaine 2 des CD4 et en interférant dans les étapes ultérieures à la fixation qui sont nécessaires à la pénétration des particules du VIH-1 dans les cellules hôtes, empêchant ainsi la transmission virale qui intervient lors de la fusion des cellules entre elles. Des études de cartographie d'épitopes indiquent que l'ibalizumab se lie à un épitope conformationnel qui se situe principalement dans le domaine 2 de la partie extracellulaire du récepteur CD4, à l'opposé du site du domaine 1 qui est requis pour la liaison du CD4 aux molécules du CMH de classe II et, par conséquent, n'interfère pas avec les fonctions immunitaires liées au CD4.
L'ibalizumab est actif contre les isolats du VIH-1 du groupe M (sous-types A, B, C, D, E ou O). Il est également actif contre le VIH-1 résistant aux médicaments antirétroviraux actuellement approuvés et présente une activité antirétrovirale contre le VIH-1 à tropisme R5 et X4 et à tropisme double.
Effets indésirables les plus fréquents: éruption cutanée (9,2 %), diarrhée (3,9 %), vertiges (3,9 %), maux de tête (3,9 %), nausées (3,9 %), fatigue (2,0 %) et vomissements (2,0 %) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l'un des excipients
Liens :
- Avis de la HAS sur TROGARZO®
- Lien vers Human medicine European public assessment report (EPAR)
- Base de données publique des médicaments (non répertorié dans la base au 11 janvier 2022)
- ANSM
Principales références :
- Blair HA. Ibalizumab: A Review in Multidrug-Resistant HIV-1 Infection. Drugs. 2020 Feb;80(2):189-196. doi: 10.1007/s40265-020-01258-3. PMID: 31970712.
- Bettiker RL, Koren DE, Jacobson JM. Ibalizumab. Curr Opin HIV AIDS. 2018 Jul;13(4):354-358. doi: 10.1097/COH.0000000000000473. PMID: 29746266.
- Iacob SA, Iacob DG. Ibalizumab Targeting CD4 Receptors, An Emerging Molecule in HIV Therapy. Front Microbiol. 2017 Nov 27;8:2323. doi: 10.3389/fmicb.2017.02323. PMID: 29230203; PMCID: PMC5711820.
- Kufel WD. Antibody-based strategies in HIV therapy. Int J Antimicrob Agents. 2020 Dec;56(6):106186. doi: 10.1016/j.ijantimicag.2020.106186. Epub 2020 Oct 9. PMID: 33045349; PMCID: PMC7546180.
- Beccari MV, Mogle BT, Sidman EF, Mastro KA, Asiago-Reddy E, Kufel WD. Ibalizumab, a Novel Monoclonal Antibody for the Management of Multidrug-Resistant HIV-1 Infection. Antimicrob Agents Chemother. 2019 May 24;63(6):e00110-19. doi: 10.1128/AAC.00110-19. PMID: 30885900; PMCID: PMC6535568.
- Markham A. Ibalizumab: First Global Approval. Drugs. 2018 May;78(7):781-785. doi: 10.1007/s40265-018-0907-5. Erratum in: Drugs. 2018 Jun;78(8):859. PMID: 29675744; PMCID: PMC5988774.
Remarque :
Dernière mise à jour : Janvier 2022
Relecture par : Pr . Carnoy