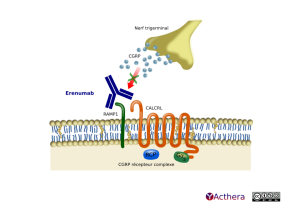
Erenumab (AIMOVIG®)
Autre nom : erenumab-aooe
Structure : AcM humain, IgG2
Code ATC : N02CD01
Nomenclature Ge : IgG2λ G2e0
Cible: CGRP receptor
Forme galénique : Stylo prérempli contenant 70 mg ou 140 mg d'erenumab
Mode d'administration : SC
Date de la première AMM : EMA juillet 2018 / FDA mai 2018
Laboratoires : Novartis AMGEN
Indications : prophylaxie de la migraine chez l'adulte ayant au moins 4 jours de migraine par mois
Prix indicatif : XXX
Usage : Prescription réservée aux spécialistes en neurologie
Posologies : 70 mg d'erenumab toutes les 4 semaines. Pour une dose de 140 mg, deux injections sous-cutanées de 70 mg doivent être administrées
Mécanisme d'action :
L'erenumab se fixe au récepteur du Calcitonin Gene-Related Peptide (CGRP) qui se trouve dans des sites impliqués dans la physiopathologie de la migraine, tels que le ganglion trigéminal. Le récepteur au CGRP est composé de 2 protéines membranaires la protéine CALCRL avec 7 domaines transmembranaires, de la protéine receptor activity modifying protein 1 (RAMP1) et de 2 protéines cytoplasmiques (receptor coupling protein (RCP) et l' α- subunit of the GS protein (GαS)).
L'erenumab se lie de manière compétitive et spécifique au récepteur du CGRP, et n'a pas d'activité significative sur les autres récepteurs de la famille des calcitonines. Le CGRP est un neuropeptide qui module le signal nociceptif et un vasodilatateur qui a été associé à la physiopathologie de la migraine. À la différence des autres neuropeptides, il a été montré que les taux de CGRP augmentent significativement durant la crise de migraine et reviennent à la normale avec le soulagement des céphalées. La perfusion intraveineuse de CGRP induit des céphalées de type migraine chez les patients.
Effets indésirables les plus fréquents : (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : xx
Principales références :
- Goadsby PJ, Reuter U, Hallström Y, et al. A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med. 2017;377(22):2123–2132. doi:10.1056/NEJMoa1705848
- Reuter U, Goadsby PJ, Lanteri-Minet M, et al. Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet. 2018;392(10161):2280–2287. doi:10.1016/S0140-6736(18)32534-0
- Dodick DW, Ashina M, Brandes JL, et al. ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia. 2018;38(6):1026–1037. doi:10.1177/0333102418759786
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments :
AIMOVIG 140 mg, solution injectable en stylo prérempli
AIMOVIG 70 mg, solution injectable en stylo prérempli
- ANSM (pas disponible au 1er juin 2022)
- Meddispar (pas disponible au 1er juin 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 1er juin 2022)
Remarque :
Dernière mise à jour : 1er juin 2022
Relecture par : Pr C. Carnoy