Atezolizumab (TECENTRIQ®)
Structure : • AcM humanisé, IgG1 (à Fc modifié)
Code ATC : L01XC32
Nomenclature Ge : IgG1 G1e8
Mode de production : Produit dans des cellules d'ovaire de hamster chinois par la technique de l'ADN recombinant
Forme galénique : Solution à diluer pour perfusion - flacons de 14 mL avec 840 mg d'atezolizumab ou flacons de 20 mL avec 1200 mg d'actezolizumab.
Mode d'administration : IV
Conservation : Le flacon non ouvert doit être conservé au réfrigérateur entre 2 et 8°C. Une fois diluée, la stabilité physique et chimique du médicament après dilution a été démontrée pendant 24 heures à ≤ 30°C et pendant 30 jours entre 2°C et 8°C depuis le moment de la préparation. D'un point de vue microbiologique, la solution pour perfusion préparée doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, les durées et conditions de conservation après dilution et jusqu’à l’utilisation sont sous la responsabilité de l’utilisateur et ne doivent normalement pas dépasser 24 heures entre 2°C et 8°C ou 8 heures à température ambiante (≤ 25°C), sauf en cas de dilution réalisée en conditions d’asepsie dûment contrôlées et validées.
Date de la première AMM : FDA 2016 / EMA septembre 2017
Laboratoire : Roche
Indications :
- Carcinome urothélial : en monothérapie dans le traitement des patients adultes atteints d'un carcinome urothélial localement avancé ou métastatique après une chimiothérapie antérieure à base de platine ou considérés inéligibles au cisplatine.
- Cancer bronchique non à petites cellules :
En monothérapie dans le traitement adjuvant, après résection complète et chimiothérapie à base de platine, des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) de stade précoce avec un risque élevé de récidive, dont les tumeurs présentent une expression de PD-L1 ≥ 50 % sur les cellules tumorales (TC) et qui ne présentent pas de CBNPC avec EGFR muté ou réarrangement du gène ALK (ALK-positif).
En monothérapie dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules (CBNPC) localement avancé ou métastatique après une chimiothérapie antérieure. Les patients avec mutations activatrices de l'EGFR ou réarrangement du gène ALK (ALK-positif) doivent également avoir reçu une thérapie ciblée avant de recevoir Tecentriq
En monothérapie dans le traitement de première ligne des patients adultes atteints d’un CBNPC métastatique dont les tumeurs présentent une expression de PD-L1 ≥ 50 % sur les TC ou ≥ 10 % sur les cellules immunitaires infiltrant la tumeur (IC) et qui ne sont pas atteints d’un CBNPC avec EGFR muté ou réarrangement du gène ALK (ALK-positif).
En association au nab-paclitaxel et carboplatine, en première ligne de traitement des patients adultes atteints d’un CBNPC non épidermoïde métastatique sans EGFR muté ou réarrangement du gène ALK (ALK-positif)
En association au bevacizumab, paclitaxel et carboplatine, en première ligne de traitement des patients adultes atteints d’un CBNPC non épidermoïde métastatique. Chez les patients atteints d’un CBNPC avec EGFR muté ou réarrangement du gène ALK (ALK-positif), Tecentriq, en association au bevacizumab, paclitaxel et carboplatine, est indiqué seulement après échec des thérapies ciblées appropriées
- Cancer bronchique à petites cellules : En association au carboplatine et à l’étoposide, en première ligne de traitement des patients adultes atteints d’un cancer bronchique à petites cellules (CBPC) de stade étendu
- Cancer du sein triple négatif : En association au nab-paclitaxel, dans le traitement des patients adultes atteints d’un cancer du sein triple négatif (CSTN) localement avancé non résécable ou métastatique, dont les tumeurs présentent une expression de PD-L1 ≥ 1 % et n’ayant pas précédemment reçu de chimiothérapie en situation métastatique
- Carcinome hépatocellulaire : En association au bevacizumab dans le traitement des patients adultes atteints d’un carcinome hépatocellulaire (CHC) avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur.
Prix indicatif : xxx
Usage : Médicament en réserve hospitalière. Médicament de prescription réservée à certains médecins spécialistes : spécialistes en oncologie et aux médecins compétents en cancérologie.
Posologies : 840 mg administrée par voie intraveineuse toutes les deux semaines, soit de 1 200 mg administrée par voie intraveineuse toutes les trois semaines, soit de 1 680 mg administrée par voie intraveineuse toutes les quatre semaines. Pour les associations, se référer aux RCP des autres produits.
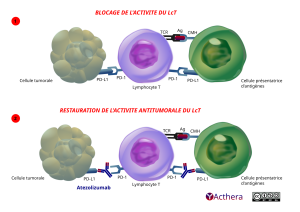
Mécanisme d'action :
PD-L1 peut être exprimé sur les cellules tumorales et/ou sur les cellules immunitaires infiltrant la tumeur. Il peut contribuer à l'inhibition de la réponse immunitaire antitumorale dans le micro-environnement tumoral. La liaison de PD-L1 aux récepteurs PD-1 et B7.1 présents sur les cellules T et sur les cellules présentatrices d'antigène inhibe l'activité cytotoxique des cellules T, la prolifération des cellules T et la production de cytokines. L'atezolizumab se lie directement à PD-L1 et assure un double blocage des récepteurs PD-1 et B7.1, empêchant l'inhibition de la réponse immunitaire médiée par PD-L1/PD-1 et réactivant la réponse immunitaire antitumorale sans induire de cytotoxicité cellulaire anticorps-dépendante. L'atezolizumab n'affecte pas l'interaction PD-L2/PD-1, permettant de maintenir les signaux inhibiteurs médiés par PD-L2/PD-1
Effets indésirables les plus fréquents: fatigue (35,4 %), diminution de l'appétit (25,5 %), nausées (22,9 %), dyspnée (21,8 %), diarrhée (18,6 %), rash (18,6 %), fièvre (18,3 %), vomissements (15,0 %)
Contre-indications : Hypersensibilité à la substance active.
Utilisation chez la femme enceinte : Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par l’atezolizumab et pendant 5 mois après l’arrêt du traitement. Aucune donnée n'est disponible concernant l'utilisation d'atezolizumab chez la femme enceinte. Les études chez l’animal ont montré que l’inhibition de la voie PD-L1/PD-1 dans des modèles murins de gestation peut entraîner un rejet d’origine immunologique du fœtus en développement conduisant à une mort fœtale.
Principales références :
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Tecentriq
- FDA
- Base de données publique des médicaments
- ANSM : lettre aux professionnels de santé concernant les risques d'EI cutanés
- Meddispar - pas de données au 13/03/23
- Centre de référence sur les agents tératogènes (CRAT) - pas de données au 26/04/24
- IMGT/DB
- HeTop
- Article du Vidal du 4 juin 2019 sur le traitement des cancers bronchiques non à petites cellules.
Remarque :
Dernière mise à jour : Mars 2023
Par : Mathilde GLAZIOU