Natalizumab (TYSABRI®) - Bioréférent
Ancien nom : Antegren®
Structure : AcM humanisé, IgG4 kappa
Code ATC : L04AA23 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs sélectifs L04AA, Natalizumab L04AA23)
Nomenclature Ge : IgG4κ G4e0
Cible: chaîne α de l'intégrine α4β1 (VLA-4), ligand de VCAM1
Mode de production : Le natalizumab est un anticorps anti-α4-intégrine humanisé recombinant, produit dans une lignée cellulaire murine par la technique de l'ADN recombinant.
Forme galénique : Solution injectable incolore à légèrement jaune, légèrement opalescente en seringues préremplies de 150 mg ou en solution pour perfusion à diluer (flacon) de 300 mg.
Mode d'administration : IV ou SC
Conservation : Les seringues doivent être conservées au réfrigérateur entre 2 et 8 °C à l'abri de la lumière. Il est possible de les garder à température ambiante (jusqu'à 25 °C) pendant 24 heures.
Date de la première AMM : EMA 2006 (Après 3 cas de LEMP (leucoencéphalopathie multifocale progressive liée au virus JC) mortelles, le natalizumab est retiré du marché le 28 Février 2005. Face à la demande des associations de patients, la FDA décide de remettre le médicament sur le marché en 2006. Extension d'indication dans la maladie de Crohn en 2008) / FDA 2004
Laboratoires : Biogen IDEC pharmaceuticals / Elan pharmaceuticals international Ltd.
Indications :
- Sclérose en plaque : TYSABRI est indiqué en monothérapie comme traitement de fond chez les adultes présentant des formes très actives de sclérose en plaques (SEP) rémittente-récurrente pour les groupes de patients suivants :
Patients présentant une forme très active de la maladie malgré un traitement complet et bien conduit par au moins un traitement de fond
Patients présentant une sclérose en plaques rémittente-récurrente sévère et d’évolution rapide, définie par 2 poussées invalidantes ou plus au cours d’une année associées à 1 ou plusieurs lésion(s) rehaussée(s) après injection de gadolinium sur l’IRM cérébrale ou une augmentation significative de la charge lésionnelle en T2 par rapport à une IRM antérieure récente.
Prix indicatif (août 2022) : 662,925€ pour 2 seringues pré-remplies de 150 mg et 1325,849€ pour 1 flacon de 300 mg de Tysabri
Usage : Médicament réservé à l’usage hospitalier. Médicament soumis à prescription initiale et renouvellement réservés aux spécialistes en neurologie. Non disponible en ville.
Posologies : Pour la sclérose en plaques et la maladie de Crohn : 300 mg 1 fois toutes les 4 semaines. La poursuite du traitement devra être reconsidérée soigneusement chez les patients ne présentant aucun signe de bénéfice thérapeutique au-delà de 6 mois.
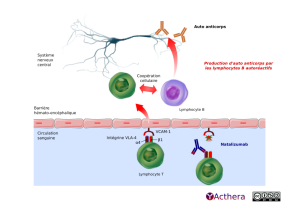
Mécanisme d'action :
Le natalizumab est un anticorps monoclonal qui se fixe à la sous-unité α4 de l'intégrine α4β1 (VLA-4) présente à la surface des LcT. L'intégrine α4β1 se fixe sur la molécule d'adhésion VCAM présente sur les cellules endothéliales de la barrière hémato-encéphalique (BHE). L'interaction VCAM/intégrine VLA-4 facilite le passage des LcT à travers la BHE. Le natalizumab bloque ainsi le passage des LcT exprimant l'intégrine α4 à travers la BHE. Cela a pour conséquence de diminuer l'inflammation au niveau du SNC et notamment de limiter l'action des LcB responsables de la production d'auto-anticorps.
Effets indésirables les plus fréquents: infection urinaire, urticaire, céphalées
Effet indésirable grave (rare) : L’utilisation de TYSABRI a été associée à un risque accru de LEMP (leucoencéphalopathie multifocale progressive), une infection opportuniste causée par le virus JC qui peut être fatale ou entraîner un handicap sévère. En raison de ce risque accru de LEMP, le neurologue et le patient devront réévaluer les bénéfices et risques du traitement par TYSABRI ; les patients devront être surveillés régulièrement tout au long du traitement. Le virus JC peut également entrainer une neuronopathie des cellules granulaires due au virus JC (NCG), qui a été rapportée chez des patients traités par TYSABRI. Les symptômes de la neuronopathie des cellules granulaires due au virus JC sont comparables aux symptômes de la LEMP (c'est à dire un syndrome cérébelleux). Les patients ayant des anticorps anti-virus JC présentent un risque accru de survenue de LEMP par rapport aux patients n’ayant pas d‘anticorps anti-virus JC.
Contre-indications : hypersensibilité au médicament, patients présentant un risque accru d'infections opportunistes, y compris patients immunodéprimés, association avec d’autres traitements de fond, cancers diagnostiqués en évolution, à l’exception des carcinomes cutanés basocellulaires, enfants et adolescents âgés de moins de 18 ans.
(Fortement) déconseillé (fonction de la balance B/R) : Aux patients qui ont des anticorps anti-virus JC et qui ont pris un traitement par TYSABRI pendant plus de 2 ans et qui ont eu antérieurement un traitement immunosuppresseur.
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est longue (16 jours en moyenne).
Utilisation chez la femme enceinte : Concernant les aspects malformatifs, les données publiées chez les femmes enceintes exposées au natalizumab au 1er trimestre de la grossesse ou dans les 3 mois précédant la conception sont nombreuses et rassurantes. Le natalizumab passe le placenta. Les concentrations plasmatiques néonatales sont nettement supérieures aux concentrations maternelles. Les données publiées chez les femmes enceintes exposées au natalizumab au 2ème et/ou 3ème trimestres de la grossesse sont peu nombreuses : Chez un tiers environ des nouveau-nés de mère traitée jusqu’au 3ème trimestre, des anémies, des thrombopénies et des leucocytoses réversibles en 4 à 16 semaines après la naissance ont été rapportée.
Mais le plus souvent, le traitement peut être arrêté pendant la grossesse car le fait d'être enceinte est bénéfique pour la maladie et diminue les poussées (discussion entre la patiente et le neurologue).
CRPV juin 2022 n°6 Bordeaux, Limoge, Poitier : Effets hématologiques réversibles (thrombopénies, anémies) sur le nourrisson exposés pendant la grossesse mais nécessitant une transfusion d'où l'intérêt d'une potentielle interruption de traitement pendant la grossesse. Si celui-ci est poursuivi, une surveillance de la présence d’éventuelles anomalies hématologiques chez le nouveau-né est recommandée lorsque les mères ont été exposées pendant le troisième trimestre de grossesse.
Les concentrations de natalizumab dans le lait sont très variables entre les études et les patientes, mais elles sont faibles le plus souvent (dosages effectués sur une quinzaine de patientes). Aucun effet particulier attribuable à l’exposition via l’allaitement n’a été mis en évidence parmi une vingtaine d’enfants allaités par des mères sous natalizumab et suivis jusqu’à 1 an. Au vu de ces éléments, l’utilisation du natalizumab est envisageable chez une femme qui allaite, sous surveillance. On préfère éviter si possible.
Principales références :
- Cervera, 2012 ; Goodin et al., 2008 ; Kudick et al., 2013
Liens :
- Avis de la HAS sur Tysabri
- Lien vers Human medicine European public assessment report (EPAR)
- FDA
- Vidal
- Article du Vidal sur la mise à disposition des seringues pré-remplies de 150 mg.
- Base de donnée publique sur les médicaments
- CRAT
- IMGT-DB
- Association française de sclérose en plaque
- ANSM
Remarque :
Dernière mise à jour : 09/22
Relecture par : Mathilde GLAZIOU