Daratumumab (DARZALEX®)
Structure : AcM humain, IgG1k
Code ATC : L01FC01
Nomenclature Ge : IgG1κ G1e0
Cible: CD38
Mode de production : Produit dans une lignée cellulaire de mammifère (ovaires de hamsters chinois ) à l’aide de la technologie de l’ADN recombinant
Forme galénique : Solution à diluer pour perfusion 20 mg/mL
Flacon de 5 mL avec 100 mg de daratumumab
Flacon de 20 mL avec 400 mg de daratumumab
Mode d'administration : IV
Conservation : Au réfrigérateur. Après dilution, d’un point de vue microbiologique, le produit doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, la durée et les conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur et ne doivent pas dépasser 24 heures au réfrigérateur (2 °C - 8 °C) à l’abri de la lumière, suivies de 15 heures (incluant la durée de la perfusion) à température ambiante (15°C - 25°C) et à la lumière ambiante. Si elle est conservée au réfrigérateur, laisser la solution atteindre la température ambiante avant de l'administrer.
Date de la première AMM : EMA 2016 / FDA 2015
Laboratoires : Janssen Biotech
Indications :
- Myélome multiple :
En monothérapie, pour le traitement des patients en rechute et réfractaire, pour lesquels les traitements antérieurs incluaient un inhibiteur du protéasome et un agent immunomodulateur et dont la maladie a progressé lors du dernier traitement ;
En association avec le lénalidomide et la dexaméthasone, ou le bortézomib et la dexaméthasone, pour le traitement des patients ayant reçu au moins un traitement antérieur.
En association avec le lénalidomide et la dexaméthasone ou avec le bortézomib, le melphalan et la prednisone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches.
En association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches.
- Amylose systémique à chaînes légères :
En association avec le cyclophosphamide, le bortézomib, et la dexaméthasone pour le traitement des patients adultes atteints d'amylose systémique à chaîne légère nouvellement diagnostiquée (médicament orphelin)
Prix indicatif :
Usage : réservé à l'usage hospitalier
Posologies : 16 mg/kg de poids corporel tous les jours pendant 8 semaines (1 à 8 semaines) puis toutes les 2 semaines (semaines 9 à 24) puis toutes les 4 semaines (à partir de la semaine 25).
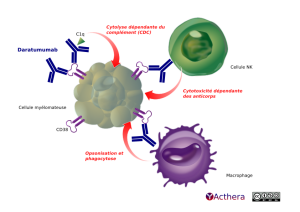
Mécanisme d'action :
Daratumumab cible le CD38 exprimé fortement par les cellules tumorales du myélome multiple. Ainsi il peut induire de la cytotoxicité dépendante des anticorps (ADCC) et du complément (CDC). Il peut aussi provoquer de la phagocytose dépendante des anticorps. En effet, en se fixant aux cellules malignes, sa partie Fc pourra interagir avec les récepteurs FcγRIIa et FcγRIII de faible affinité présents sur les macrophages. Cette interaction facilite la phagocytose des cellules tumorales opsonisées. In vitro et in vivo il a également démontré sa capacité à provoquer l'apoptose des cellules tumorales. Daratumumab module également in vitro l'activité enzymatique de CD38 modulant la mobilisation calcique au sein des cellules tumorales, favorisant la mort cellulaire.
Effets indésirables les plus fréquents: pneumonie, infection des voies respiratoires supérieures, anémie, céphalées, toux, dyspnées, nausées et diarrhées
Contre-indications : hypersensibilité au médicament
Utilisation chez la femme enceinte : Les femmes en âge de procréer doivent utiliser une contraception efficace pendant et jusqu’à 3 mois après l’arrêt du traitement par daratumumab. Il n’a pas été établi si le daratumumab est excrété dans le lait maternel humain.
Principales références :
- Lokhorst JM et al., Targeting CD38 with daratumumab monotherapy in multiple myeloma, N Engl J Med, 2015;373:1207-1219 ; S Lonial et al., Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial, Lancet 2016.
Liens :
- Avis de la HAS sur Darzalex
- Lien vers Human medicine European public assessment report (EPAR)
- FDA
- Bases de données publique des médicaments
- Vidal
- Meddispar ; pas de données au 07/05/23
- CRAT ; pas de données au 07/05/23
- IMGT
- HeToP
Remarque :
Dernière mise à jour : 05/23
Par : Mathilde GLAZIOU